- 大分類
-
- 凝固
- 小分類
-
- 分子
組織因子(TF) tissue factor
解説
【概要】組織因子(TF)は、活性化凝固第Ⅶ因子(第Ⅶa因子:FⅦa)と複合体を形成して凝固第Ⅸ因子(FⅨ)および凝固第Ⅹ因子(FⅩ)を活性化する外因系凝固反応の開始因子である。TFは通常、血管外の繊維芽細胞などに豊富に発現しており、血管傷害で血液が流出した際は直ちに血中のFⅦ/FⅦaを結合して凝固プロテアーゼ活性化のカスケード反応を開始させる。他方、感染や炎症の際には、単球や内皮細胞などの血液接触細胞にも組織因子の発現が誘導されるが、これは血栓による異物の封じ込めや炎症反応の増幅、創傷治癒などに機能すると考えられている。
【構造と機能】分子量47,000(263アミノ酸残基)の1回膜貫通型の糖タンパク質である。TFの細胞外ドメインの大半はβシート構造からなっており、クラスIIサイトカイン受容体ファミリーに分類される(図1)。FⅦaはTFを取り囲むように細胞外ドメイン全体にわたって接触している。
【病態との関わり】感染や炎症で単球などにおけるTFの発現が誘導された場合、播種性血管内凝固症候群(DIC)の要因となる。動脈硬化性プラークにおいては、マクロファージや平滑筋細胞などにTFは発現しており、プラーク破綻の際,血栓形成を惹起する。また、酸化LDL(低密度リポタンパク)はTF発現を誘導し、高脂血症患者の易血栓性に関与する。多くのがん細胞ではTFが高発現しており、患者の易血栓性に関連する。以上の病態において、血中にTF発現細胞から放出されるTF陽性細胞外小胞が血栓形成に関与する例も報告されている(後述)。
【TFによる細胞機能の修飾】TF・FⅦaやその下流で活性化されるトロンビンなどの凝固プロテアーゼは、プロテアーゼ活性化受容体 (PAR)の活性化を介して、遺伝子発現の制御や細胞遊走、細胞死の抑制、炎症、創傷治癒、血管形成・新生、感染などの制御に関与する。4種のPARの内、TF経路の開始反応で生成するTF・FⅦa やFⅩaはPAR2を活性化する。TF・FⅦaによって活性化されたFⅩaはTF・FⅦaからの解離速度が遅く、一時的にTF・FⅦa・FⅩa三者複合体を形成して留まるが、このFⅩaは遊離のFXaと異なりTFPI(Tissue Factor Pathway Inhibitor)による阻害を受けず1)、PAR2を活性化する。こうしたPAR2シグナルと下流のトロンビンなどで活性化されるPAR1シグナルを生体内で区別することは難しいが、それぞれの欠損マウスの比較から、虚血再灌流モデルにおける心筋梗塞サイズの増大にはPAR2のみが関与していることが報告されている2)。また、食餌誘発性の肥満モデルマウスにおいて、PAR2シグナルは脂肪組織における炎症を促進するという3)。TF・FⅦaは、膜貫通型セリンプロテアーゼであるマトリプターゼを活性化するので、マトリプターゼを介した細胞機能修飾作用も示唆されている4)。
【ノックアウトマウスの表現型】TF欠損マウスは卵黄嚢などの血管形成不全で胎性致死である。発生時の血管形成作用にTFの細胞内ドメインは必要でなく、TFによる凝固反応の活性化とPARシグナルの寄与が大きいことが示唆されている。また、TF欠損マウスにヒトTF minigeneを導入したTF低発現マウス(1%未満のTF活性)では正常に出生・成長する個体もあり、TFの機能解析に用いられている。TF低発現マウスは出血傾向を示し、母体の出産時の出血性合併症や心臓における出血とこれに起因する心筋の線維化により短命であることが報告されている。
【ヒトにおけるTF欠損】原因不明の出血傾向を示す983名の全ゲノムシーケンス解析の結果、TF遺伝子の片方のアレルにのみ2塩基欠損を有するヘテロ接合型の1例が見つかった5)。このアレルから発現されるTF mRNAは、フレームシフト変異で未成熟終止コドンが出現する。そのため、ナンセンス変異依存mRNA分解機構(Nonsense-mediated mRNA decay)で分解され、たとえ翻訳されても、TF活性は検出されないことが示唆されている。ヘテロ接合体は少なくとも25,000人に1人の割合で認められる。
【TF・FⅦa・FⅩa三者複合体によるFⅧの活性化】TF・FⅦa・FⅩa複合体中のFⅩaは、遊離のFXaとは基質特異性が異なり(TFPIにより阻害されないことは前述したが)、FⅧを活性化することが示されている1)。したがって、TF・FⅦa とTF・FⅦa・FⅩaによってそれぞれFⅨとFⅧが活性化され、外因系開始反応のごく初期に内因系FⅩ活性化複合体(内因系テンナーゼ)が形成される機序が提唱されている。
【各組織・細胞におけるTF発現】TFは通常、血管壁外膜の繊維芽細胞や微小血管の周皮細胞、皮膚の角化細胞、臓器被膜などの上皮層に豊富に発現しており、生理的血栓形成(止血)に機能する。中膜平滑筋細胞での発現は少ないが、塩化鉄による内膜傷害モデルにおいては、TFが平滑筋細胞に速やかに誘導されて凝固反応を開始する6)。TFは、脳や肺、胎盤などに非常に多い。これよりは少ないが心臓、腎臓、腸、子宮、精巣などにも豊富に発現している。脳では主にアストロサイトに発現しており、外傷性脳損傷の際の出血阻止に機能する。他方、脳におけるTF発現量を通常の5%程度に低下させたところ、虚血再灌流傷害が軽減することが報告されている7)。機械的に血管が損傷されやすい心臓や肺において、TFは線維芽細胞以外に心筋細胞や肺胞上皮細胞にも発現している8)。腎臓では通常、糸球体壁上皮細胞やポドサイト、メサンギウム細胞に発現している。糸球体腎炎では集積したマクロフォージがTFを発現し、フィブリン沈着やPARを介して、糸球体病変の進展に関与する9)。また、抗リン脂質抗体症候群における血栓性微小血管障害モデルマウスでは、補体系活性化に依存的あるいは非依存的に糸球体のTF発現が促進されることが示唆されている10)。骨格筋や滑膜組織(関節)はTF発現量が少ない組織であり、血友病患者ではこうした組織において自然出血がみられる。
【TF活性の潜在化と顕在化】細胞膜表面に発現したTFは通常、不活性の状態(TF encryption:TF活性の潜在化)で存在しており、細胞が傷害あるいは活性化された際に、TF活性が顕在化(TF decryption)することが示唆されている11)。TF・FⅦaによるFⅩの活性化を含め、凝固反応を促進するホスファチジルセリン(PtdSer)やPtdSerの作用を増強するホスファチジルエタノールアミン(PtdEth)といったアミノリン脂質は、細胞膜二重層の内層(細胞質側)に局在している。他方、コリン基を有するリン脂質であるホスファチジルコリンやスフィンゴミエリン(SM)は外層(表層)に多く、TF活性を不活性の状態に維持しているが(TF encryption)、細胞が傷害あるいは活性化された際にはPtdSerやPtdEthが表出してTF活性を顕在化させる。また、酸性スフィンゴミエリナーゼによるSMのセラミドへの変換がTF顕在化に関与することも報告されている12)。PDI(Protein disulfide isomerase)による凝固反応や細胞接着の制御機構が注目されているが13)、TF活性の潜在化・顕在化への関与も報告されている。この機序においては、TF活性に必須のCys186-Cys209ジスルフィド結合の形成が、PDIやチオレドキシンシステムによって制御されるという14)。
【血液接触細胞および血中の細胞外小胞のTF】TF発現は、単球の他、内皮細胞や好中球、血小板などで誘導されることが報告されているが、DICなどのグラム陰性細菌感染に伴う病態においては主に単球が発現するTFが凝固反応活性化に機能することが示唆されている15)。この際、パイロトーシス16)などによって血中に放出されるTF陽性細胞外小胞(TF+ extracellular vesicle:TF+EV)は、PtdSerも陽性であり、病態形成や悪化に関与すると示唆されている17)。これとは別に、がん細胞由来のTF+EVが凝固活性を有することが明らかにされており、膵がん患者においてはTF+EVと静脈血栓塞栓症との連関が報告されている17)。
図表
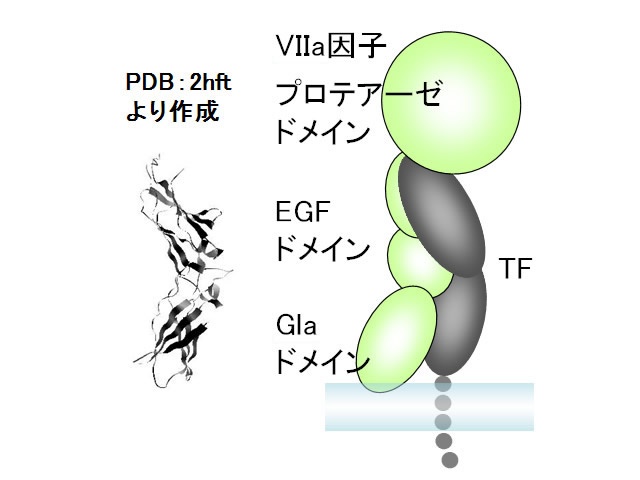
図1 組織因子(TF)細胞外ドメインの立体構造(左)およびⅦa因子との複合体の模式図(右:PDB 1danの複合体構造を基に作成)
引用文献
- Kamikubo Y, Mendolicchio GL, Zampolli A, et al.: Selective factor VIII activation by the tissue factor-factor VIIa-factor Xa complex. Blood 130: 1661-1670, 2017
- Antoniak S, Rojas M, Spring D, et al.: Protease-activated receptor 2 deficiency reduces cardiac ischemia/reperfusion injury. Arterioscler Thromb Vasc Biol 30: 2136–2142, 2010
- Badeanlou L, Furlan-Freguia C, Yang G, et al.: Tissue factor-protease-activated receptor 2 signaling promotes diet-induced obesity and adipose inflammation. Nat Med 17: 1490–1497, 2011
- Le Gall SM, Szabo R, Lee M, et al.: Matriptase activation connects tissue factor-dependent coagulation initiation to epithelial proteolysis and signaling. Blood 127: 3260-3269, 2016
- Schulman S, El-Darzi E, Florido MH, et al.: A coagulation defect arising from heterozygous premature termination of tissue factor. J Clin Invest 130: 5302-5312, 2020
- Wang L, Miller C, Swarthout RF, et al. Vascular smooth muscle-derived tissue factor is critical for arterial thrombosis after ferric chloride-induced injury. Blood 113: 705-713, 2009
- Wang S, Reeves B, Sparkenbaugh EM, et al.: Protective and detrimental effects of neuroectodermal cell-derived tissue factor in mouse models of stroke. JCI Insight 1: e86663, 2016
- Antoniak S, Tatsumi K, Hisada Y, et al.: Tissue factor deficiency increases alveolar hemorrhage and death in influenza A virus infected mice. J Thromb Haemost 14: 1238–1248, 2016
- Madhusudhan T, Kerlin BA, Isermann B.: The emerging role of coagulation proteases in kidney disease. Nat Rev Nephrol 12: 94–109, 2016
- Seshan SV, Franzke CW, Redecha P, et al.: Role of tissue factor in a mouse model of thrombotic microangiopathy induced by antiphospholipid antibodies. Blood 114: 1675-1683, 2009
- Ansari SA, Pendurthi UR, Rao LVM.: Role of cell surface lipids and thiol-disulphide exchange pathways in regulating the encryption and decryption of tissue factor. Thromb. Haemost 119: 860–870, 2019
- Wang J, Pendurthi UR, Yi G, et al.: SARS-CoV-2 infection induces the activation of tissue factor-mediated coagulation via activation of acid sphingomyelinase. Blood 138: 344-349, 2021
- Gaspar RS, Gibbins JM.: Thiol Isomerases Orchestrate Thrombosis and Hemostasis. Antioxid Redox Signal 35: 1116-1133, 2021
- Rothmeier AS, Marchese P, Petrich BG, et al.: Caspase-1-mediated pathway promotes generation of thromboinflammatory microparticles. J Clin Invest 125: 1471–1484, 2015
- Popescu NI, Lupu C, Lupu F.: Disseminated intravascular coagulation and its immune mechanisms. Blood 139: 1973-1986, 2022
- Wu C, Lu W, Zhang Y, et al.: Inflammasome activation triggers blood clotting and host death through pyroptosis. Immunity 50: 1401-1411.e4, 2019
- Hisada Y, Sachetto ATA, Mackman N.: Circulating tissue factor-positive extracellular vesicles and their association with thrombosis in different diseases. Immunol Rev doi: 10.1111/imr.13106, 2022
