- 大分類
-
- 凝固
- 小分類
-
- 分子
TFPI(tissue factor pathway inhibitor)
解説
■概要
TFPI(Tissue Factor Pathway Inhibitor)は血液中に存在する生理的な抗凝固因子として1988年にBrozeらにより肝がん細胞から発見されたセリンプロテアーゼインヒビターである。遺伝的背景の異なる2種類のTFPI(TFPI-1とTFPI-2)が存在するが、TFPIと言えばTFPI-1のことを指し、TFPI-2はplacental protein 5 (PP5)と同一タンパク質である。TFPIには3種類のスプライシング異性体(TFPIα、TFPIβ、TFPIδ)が存在し、またそれぞれには遊離型や細胞表面結合型など異なる存在様式がみられる。TFPIαはアミノ酸数が276個と最長で、酸性アミノ酸に富むN末端領域、3個の縦列のクニッツ型阻害領域(K1,K2,K3)、塩基性アミノ酸に富むC末端領域が存在する。TFPIβはK3以降のC末端領域を欠き、193個のアミノ酸のC末端に存在するglycosyl phosphatidyl inositol (GPI) アンカーを介して細胞表面に結合している。TFPIδはK2ドメインまでの162個のアミノ酸からなるが、生理的意義は不明である。TFPIは活性化凝固第Ⅹ因子(FⅩa)並びに組織因子・活性化凝固第Ⅶ因子(TF・FⅦa)複合体と結合して、外因系凝固反応を抑制する。近年になって、TFPIαが凝固第Ⅴ因子やプロテインSと相互作用することを介して抗凝固機能を発揮することも判明している。
■分子量、産生部位、血中濃度
TFPIαの分子量は糖鎖の結合状態により約32kD(mw 31,950)-43kDと不均一である。TFPIの産生場所は血管内皮細胞(特に毛細血管)を中心に、血管平滑筋細胞や線維芽細胞、巨核球、血小板、単球などである。ヒト血漿中の総TFPI濃度は50~90 ng/mL(1.5~2.5nM程度)で、約80%がリポタンパク質(LDL;HDL;;VLDL)結合型である。残りの20%程度が遊離型で、その約半分はC末端領域が欠損している。ヘパリンの投与により血管内皮細胞のグリコサミノグリカン(GAG)に結合したTFPI(主にC末端を保持しているTFPIα)が遊離して血中濃度が1.5~3倍に上昇するが、近年になって、phosphatidyl inositol-specific phospholipase C (PIPLC)の処理によりヘパリン処理の10倍以上も血中TFPI濃度が高まることが報告され、血管内皮細胞表面にTFPIβが多量に結合していると考えられるようになった。また、血小板の活性化に伴ってTFPIαが血小板内から膜表面に発現増加することも明らかにされている。
■構造と機能
TFPIは2q32(TFPI-2は7q22)染色体に位置し、10個のエクソンを含む約90kbの塩基で構成される。TFPIαは分子内に9個のジスルフィド架橋を形成する。TF/ⅦaやFⅩaに対する阻害活性はC末領域(一部はK3ドメイン)を介してGAGに結合した血管内皮細胞上のTFPI(TFPIα)が最も強力とされ、遊離型TFPIαの凝固阻害活性は細胞膜結合TFPIβと比較しても弱い。また、C末領域に血中のリポプロテインや特に酸化LDLが結合しているリポタンパク質結合型TFPIは凝固阻害活性が弱い。
■ノック・アウトマウスの表現形
TFPIK1-/-(K1ドメインホモ欠失マウス)では、胎齢11.5日までに約半数が死亡し、卵黄嚢内出血、血管内血液損失が認められ、凝固障害により全頭死亡した。FⅦ-/-/TFPIK1-/-(FⅦ欠失、K1ドメインホモ欠失)マウスとFⅦ+/+/TFPIK1-/-マウスとの比較から、TFPIK1ノックアウトの死因は血管形成不全ではなく、凝固障害によると考えられている。
■病態との関わり
TFPIには敗血症やDIC動物モデルでの血栓形成の抑制や生存率の改善があり、またバルーン血管形成術後の狭窄の減弱などが認められたことから、以前より敗血症に対する遺伝子組換えTFPI製剤による治療が試みられていたが、良い成果は得られていない。TFPI のC末の塩基性アミノ酸領域が平滑筋細胞の増殖を抑制すること、また内皮細胞にはアポトーシスを促進して増殖抑制作用を示すことが報告されている。
■その他のポイント
近年になって、プロテインSがTFPIのK3ドメインを介してTFPIとFⅩaとの結合を促進させ、活性化プロテインC非依存的にTFPIのFⅩa阻害活性を顕著に高めること、また、TFPIαのC末領域が血小板膜リン脂質や活性化第V因子(FⅤa)との結合を介してプロトロンビナーゼ(FⅩa-FⅤa-リン脂質複合体)の働きを抑制することなどの重要な発見があり、TFPIに関する研究の新展開が期待される。
■お役立ち情報
血友病治療に対してTFPIの阻害剤(核酸や抗体)による臨床研究が行われている。
図表
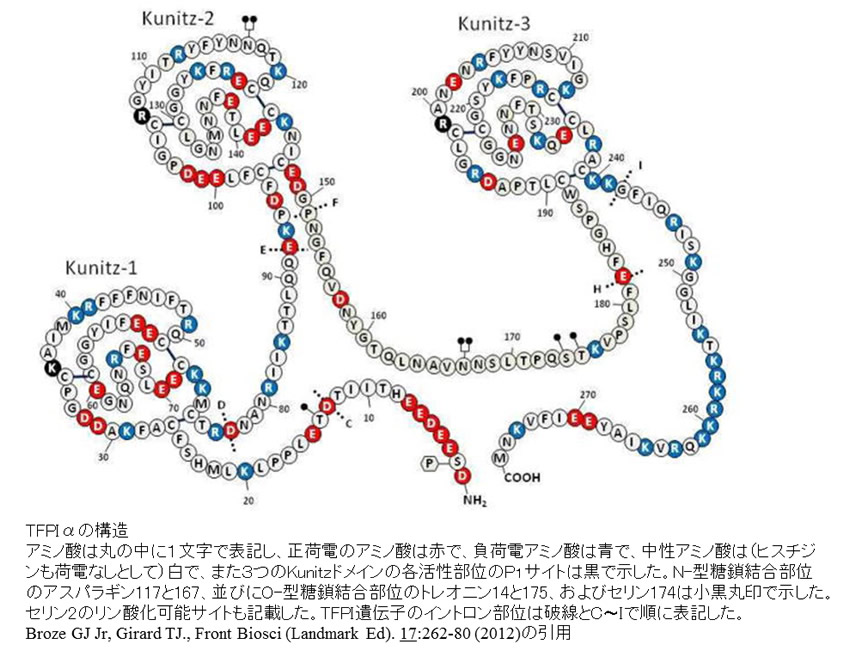
TFPIαの構造(Broze GJ Jr, Girard TJ.より引用)
参考文献
1) 坂田飛鳥,大森司:Tissue factor pathway inhibitor(TFPI)の基礎,特集・血液凝固の制御機構と臨床応用への展望,日本血栓止血学会誌 25:5-10,2014.
2) 荻原 建一,野上 恵嗣:Tissue factor pathway inhibitor(TFPI)の新知見と臨床応用,特集・血液凝固の制御機構と臨床応用への展望,日本血栓止血学会誌 25:11-22,2014.
