- 大分類
-
- 血小板
- 小分類
-
- 分子
フォン・ヴィレブランド因子(VWF) von Willebrand factor(VWF)
解説
【概要】
フォン・ヴィレブランド因子(von Willebrand factor;VWF)は血管損傷部位の初期血小板粘着、血小板凝集、凝固第VIII因子の安定化作用をもつ高分子の血漿糖タンパク質である.VWF遺伝子は第12染色体の短腕上に存在し、全長は178 kbpである.VWFは血管内皮細胞や巨核球で産生される.血管内皮細胞のWeibel-Palade小体に存在し、超巨大マルチマーとして分泌され、VWF切断酵素ADAMTS13によって、止血機能に適切な大きさに切断される.
【分子量】
約250 kDaのタンパク質である.血中では種々の大きさのマルチマーが存在する(500〜15,000 kDa).VWFはpre-pro-VWFサブユニットとして小胞体で翻訳され、シグナルペプチドの切断、糖鎖付加、CKドメインによる二量体形成の後、ゴルジ体でプロペプチドが切断されN末端でのジスルフィド結合によってマルチマーを形成する.
【半減期】
12から16時間
【血中濃度】
約10 µg/mL、日常診療での測定値は正常血漿との%で表される.血液型がO型であると血中VWF濃度が低い.
【構造と機能】
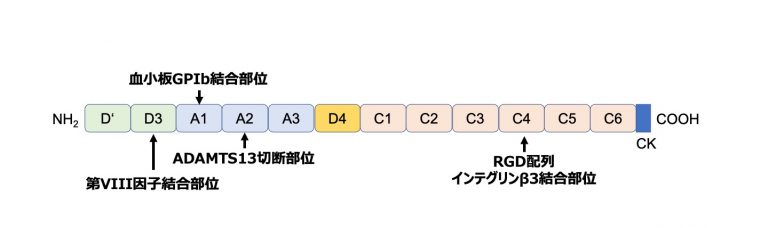
VWFは様々な分子や細胞と結合することができる(図).VWFのドメイン構造はZhouら(Blood 2012;125:2019-2028)の報告以降、大きく変わり、D’-D3-A1-A2-A3-D4-C1-C2-C3-C4-C5-C6-CKと表記されるようになった(Kawecki et al, JTH 2017;15:1285-1294)。主なドメイン別の機能としてはD3が凝固第VIII因子結合部位、A1が血小板GPIb結合部位、A2がADAMTS13による切断部位、A3がコラーゲン結合部位、C4がRGD配列によるβ3インテグリン結合部位(「GPIIb/IIIa(インテグリンαIIb/β3)」参照)、CKがジスルフィド結合によりVWFのマルチマー形成を担う部位である.VWFはマルチマー形成をしていることで、その構造がずり応力によって伸長されることによって、其々のドメインの結合部位が露出して機能を発揮するようになる.リストセチンやヘビ毒ボトロセチンは、ずり応力とは無関係に非生理的にVWFと血小板GPIbとの結合を促進する.
【ノックアウトマウスの表現形】
VWF欠損マウスはメンデルの法則にしたがって出生する.ホモ欠損マウスの約10%のマウスは新生児に自発的出血を認め、出血時間の著明な延長を呈する.血漿中の凝固第VIII因子は野生型マウスの20%にまで低下する.フィブリノゲンとの二重欠損マウスでは23%が離乳前に死亡する.興味深いことに二重欠損マウスでも、時間はかかるが、in vivoでの血小板粘着、脆い血小板凝集塊を形成する.
【病態との関わり】
VWFの質的・量的異常は、出血性疾患であるフォン・ヴィレブランド病(VWD)として知られている.VWF遺伝子の異常に伴う先天性の症例が多いが、自己抗体が原因となる後天性フォン・ヴィレブランド病、また弁膜症が原因となるHeyde症候群もある.VWFが低下すると凝固第VIII因子が低下するため血友病Aとの鑑別が問題となる.VWF切断酵素ADAMTS13の遺伝的・後天的欠損が血栓性血小板減少性紫斑病(TTP)(先天性TTP、後天性TTP)の原因である.ADAMTS13の欠乏によって生じた超巨大VWFマルチマーによって血小板血栓が惹起される.血漿VWFの上昇が、心血管イベントに関連する報告もある.逆にO型血液型では外傷時の出血が多いという報告もある。
図表
参考文献
1)Blood. 2014;124(9):1412-25.
2)血小板生物学.池田康雄,丸山征郎 編,メディカルレビュー社,2004年,p341-348.
3)血栓止血誌2001;12(1):78-84.
4)血栓止血誌1999;10(2/3):212-218.