- 大分類
-
- 血小板
- 小分類
-
- 分子
GPIIb/IIIa(インテグリンαIIb/β3) GPIIb/IIIa (integrin αIIb/β3)
解説
インテグリンファミリーに属する血小板膜糖タンパクであり、GPIIb(インテグリンαIIb)とGPIIIa(インテグリンβ3)がCa2+依存性に1:1の非共有結合を形成している。血小板表面に最も豊富に発現する膜タンパクであり、フィブリノゲンおよびフォン・ヴィレブランド因子の受容体として血小板凝集塊形成に必須の分子である。
【分子量・構造】
【生合成】
【遺伝子】
【分布】
【機能】
【先天性欠損症・異常症】
αIIbβ3欠損症は(グランツマン)血小板無力症として知られており、幼小児期より強い出血傾向を呈する8)。細胞膜貫通領域付近に存在する活性化変異により先天性巨大血小板減少症となることが最近報告されている9)。またキンドリン3の先天的な欠損は、白血球および血小板のインテグリン活性化障害を生じ、免疫不全症とともに血小板無力症様の出血症状を呈する。白血球接着不全症候群(LAD)3型と呼ばれる10)。
図表
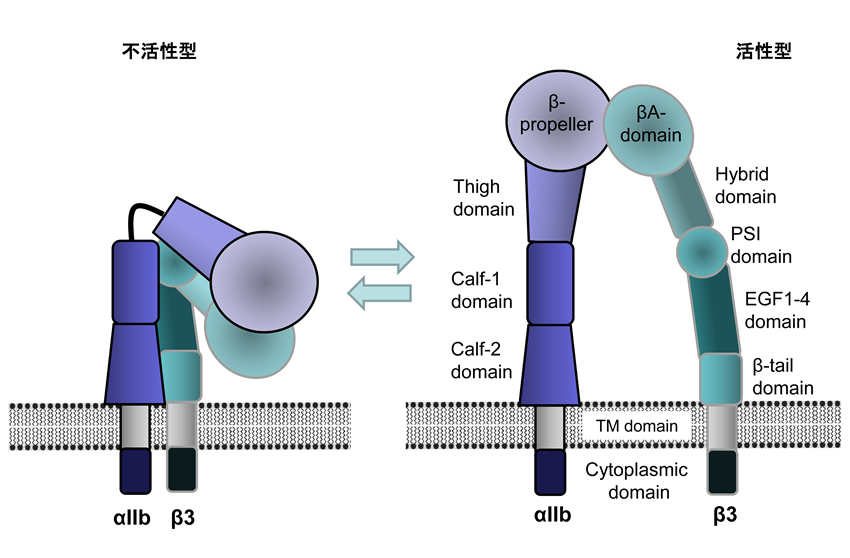
αIIbβ3は通常、不活化状態にあるが(左)、活性化に伴い構造変化し活性型となる(右)。
引用文献
1) Xiong JP, Stehle T, Diefenbach B, Zhang R, Dunker R, Scott DL, Joachimiak A, Goodman SL, Arnaout MA: Crystal structure of the extracellular segment of integrin alpha Vbeta3. Science 294(5541): 339-345, 2001.
2) Shattil SJ, Kim C, Ginsberg MH: The final steps of integrin activation: the end game. Nat Rev Mol Cell Biol 11(4): 288-300, 2010.
3) Duperray A, Troesch A, Berthier R, Chagnon E, Frachet P, Uzan G, Marguerie G: Biosynthesis and assembly of platelet GPIIb-IIIa in human megakaryocytes: evidence that assembly between pro-GPIIb and GPIIIa is a prerequisite for expression of the complex on the cell surface. Blood 74(5): 1603-1611, 1989.
4) Entrez Gene: ITGA2B integrin, alpha 2b (platelet glycoprotein IIb of IIb/IIIa complex, antigen CD41).
5) Entrez Gene: ITGB3 integrin, beta 3 (platelet glycoprotein IIIa, antigen CD61).
6) Robin C, Ottersbach K, Boisset JC, Oziemlak A, Dzierzak E: CD41 is developmentally regulated and differentially expressed on mouse hematopoietic stem cells. Blood 117(19): 5088-5091, 2011.
7) Moser M, Legate KR, Zent R, Fässler R: The tail of integrins, talin, and kindlins. Science 324(5929): 895-899, 2009.
8) Nurden AT, Fiore M, Nurden P, Pillois X: Glanzmann thrombasthenia: a review of ITGA2B and ITGB3 defects with emphasis on variants, phenotypic variability, and mouse models. Blood 118(23): 5996-6005, 2011.
9) Kashiwagi H, Kunishima S, Kiyomizu K, Amano Y, Shimada H, Morishita M, Kanakura Y, Tomiyama Y: Demonstration of novel gain-of-function mutations of αIIbβ3: association with macrothrombocytopenia and glanzmann thrombasthenia-like phenotype. Mol Genet Genomic Med 1(2): 77-86, 2013.
10) Svensson L, Howarth K, McDowall A, Patzak I, Evans R, Ussar S, Moser M, Metin A, Fried M, Tomlinson I, Hogg N: Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat Med 15(3): 306-12, 2009.
