- 大分類
-
- 線溶
- 小分類
-
- 病態
悪性腫瘍と線溶
解説
悪性腫瘍においてはセリンプロテアーゼのひとつであるウロキナーゼ型プラスミノゲンアクチベータ(uPA)や組織型プラスミノゲンアクチベータ(tPA)が発現し、uPAはプラスミノゲンを加水分解しプラスミンへと活性化させ、さらにはpro-collagenaseを活性化することによって、細胞外マトリックスを融解することにより悪性腫瘍の浸潤・転移に関与すると考えられている1).また、腫瘍間質部の線維芽細胞は、プラスミノゲンアクチベータインヒビター1(PAI-1)やPAI-2を分泌し、効率よくuPAと結合してその活性を阻害するものと考えられている2)3).PAI-1、PAI-2、およびuPAの受容体であるウロキナーゼ型プラスミノゲンアクチベータ受容体(uPAR)は腫瘍浸潤部に多く局在し、腫瘍と間質の相互作用が示唆された(図1)4).uPAの強発現は予後不良因子と考えられる. uPARはVEGF(Vascular endothelial growth factor)を誘導し血管新生に関与し5,6)、インテグリンに影響し癌細胞の接着にも関係する7).PAI-1はuPA/uPARと細胞外マトリックスタンパク質との結合を修飾し、浸潤・増殖を促進する可能性も示されている。上皮間葉転換(epitherial-mesenchymal transition; EMT)においても、uPA/uPARは、Ras遺伝子を活性化する遺伝子を抑制することにより、EMTや幹細胞様の性質をもつ細胞を誘導するという報告がある8).急性前骨髄性白血病(APL)や一部の固形癌では血管内皮やマクロファージや腫瘍細胞の膜表面にアネキシンA2が存在し、tPAおよびプラスミンと結合してプラスミノゲンを活性化することによって、播種性血管内凝固症候群(DIC)を引き起こすといわれている9).
■乳癌の予後因子としてのuPA /PAI
American Society of Clinical Oncologyの前向きランダム化試験におけるChemo-N0 trial(1993-1998、n=647)の10年最終解析が論文として報告された10).乳がんにおいて腫瘍組織中のuPAとPAI-1抗原量は独立した予後規定因子であると報告されている10).またn0症例に限定し、乳癌組織におけるuPAとPAI-1のいずれかが高発現(n=181)であれば経過観察群にくらべて化学療法群で有意に無再発生存率 (DFS) が良好であった11).
■癌治療への応用
抗uPAR抗体によるマウスの腫瘍の縮小効果12)が確認されており、今後臨床への応用が期待される.
図表
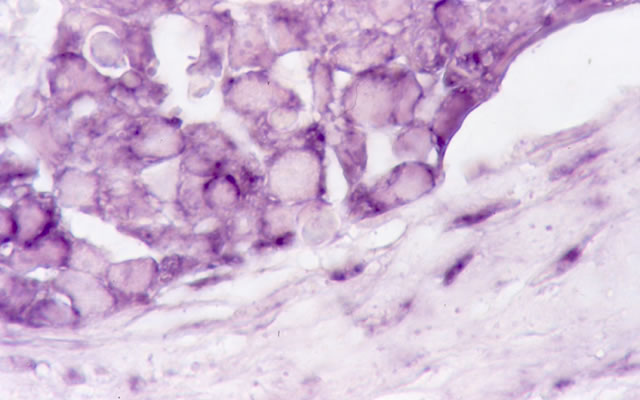
図1
参考文献
1) Mignatti P, Rifkin DB: Biology and biochemistry of proteinases on tumor invasion. Physiol Rev 73: 161
2) Grøndahl-Hansen J, Christensen IJ, Rosenquist C, Brünner N, Mouridsen HT, Danø K, Blichert-Toft M: High levels of urokinase-type plasminogen activator and its inhibitor PAI-1 in cytosolic extracts of breast carcinomas are associated with poor prognosis. Cancer Res 53: 2513
3) Danø K, Behrendt N, Brunner B, Ellis V, Ploug M, Pyke, 高橋敬, 坂田洋一訳: The urokinase receptor. Protein structure and role in plasminogen activator and cancer invasion. 血栓止血誌 6:212
4) Umeda T, Eguchi Y, Okino K, Kodama M, Hattori T: Cellular localization of urokinase-type plasminogen activator, its inhibitors, and their mRNAs in breast cancer tissues. J Pathol 183: 388
5) Uhrin P, Breuss JM: uPAR: a modulator of VEGF-induced angiogenesis. Cell Adh Migr 7: 23
6) Rao JS, Gujrati M, Chetty C: Tumor-associated soluble uPAR-directed endothelial cell motility and tumor angiogenesis. Oncogenesis 2: e53, 2013.
7) Noh H, Hong S, Huang S: Role of urokinase receptor in tumor progression and development. Theranostics 3: 487
8) Jo M, Eastman BM, Webb DL, Stoletov K, Klemke R, Gonias SL: Cell signaling by urokinase-type plasminogen activator receptor induces stem cell-like properties in breast cancer cells. Cancer Res 70: 8948
9) Menell JS, Cesarman GM, Jacovina AT, McLaughlin MA, Lev EA, Hajjar KA: Annexin II and bleeding in acute promyelocytic leukemia. N Engl J Med 340: 994
10) Harbeck N, Schmitt M, Meisner C, Friedel C, Untch M, Schmidt M, Sweep CG, Lisboa BW, Lux MP, Beck T, Hasmüller S, Kiechle M, Jänicke F, Thomssen C; Chemo-N 0 Study Group: Ten-year analysis of the prospective multicentre Chemo-N0 trial validates American Society of Clinical Oncology (ASCO)-recommended biomarkers uPA and PAI-1 for therapy decision making in node-negative breast cancer patients. Eur J Cancer 49: 1825
11) Jacobs VR, Kates RE, Kantelhardt E, Vetter M, Wuerstlein R, Fischer T, Schmitt M, Jaenicke F, Untch M, Thomssen C, Harbeck N: Health economic impact of risk group selection according to ASCO-recommended biomarkers uPA/PAI-1 in node-negative. Breast Cancer Res Treat 138: 839
12) LeBeau AM, Duriseti S, Murphy ST, Pepin F, Hann B, Gray JW, VanBrocklin HF, Craik CS: Targeting uPAR with antagonistic recombinant human antibodies in aggressive breast cancer. Cancer Res 73: 2070
