- 大分類
-
- 線溶
- 小分類
-
- 分子
ウロキナーゼ型プラスミノゲンアクチベータ受容体(uPAR) urokinase-type plasminogen activator receptor (uPAR)
解説
【分子量・構造】
ウロキナーゼ型プラスミノゲンアクチベータ受容体(uPAR)はタンパク質部分の分子量が35 kDa、糖鎖修飾を含むと分子量55-65 kDaのグリコシルホスファチジルイノシトール (GPI)アンカー型膜タンパク質であり、D1、D2、D3の3つのドメインからなる。また、GPIアンカーが切断されて生成する可溶型uPAR(suPAR、D1-D3を含む)、さらにプロテアーゼにより切断されて生成するuPAR D2-D3ドメインが血漿中に存在する。uPARは不活性一本鎖および活性二本鎖uPAに高い親和性を持ち、不活性ウロキナーゼ型プラスミノゲンアクチベータ(uPA)がuPARに結合すると活性化されやすくなる。またGPIアンカーから遊離した可溶型uPAR (suPAR) が血中に存在する。uPAはD1ドメインに結合し、D3ドメインもその結合を促進する。主に白血球、線維芽細胞、血管平滑筋細胞、新生血管内皮細胞、骨髄細胞などの細胞での発現が報告されている。
【機能】
uPARは細胞膜脂質二重層の外側に分布しており、uPAに結合することにより細胞表面にuPAを接着し、細胞周囲でのuPA-プラスミン-マトリックスメタロプロテイナーゼ系の活性化、およびそれに続く細胞外マトリックス(ECM)の分解を促進し、細胞の遊走に寄与する。また、ECMタンパク質の1つであるビトロネクチン(vitronectin)とuPA依存的に結合することにより、細胞接着に関与する。uPARを含むGPIアンカー型膜タンパク質は細胞膜のラフト(raft)と呼ばれる難溶性脂質膜領域に局在している。このraftにはシグナル伝達に寄与するタンパク質が局在していることから、uPARは他のシグナル伝達タンパク質と相互作用すると考えられており、実際ECM受容体であるインテグリン、およびGタンパク質共役受容体であるホルミルペプチド受容体(formyl peptide receptor)L1との相互作用により細胞内にシグナルを伝達することが報告されている。これらのシグナルは細胞の接着、増殖、遊走の制御に寄与している。さらに可溶性D2-D3ドメインのN末端SRSRYは走化性因子として機能する。
【病態との関わり】
病態においては、炎症(動脈硬化、関節炎)に伴う発現の増加が報告されている。また近年、巣状分節性糸球体硬化症においてsuPARがβ3インテグリンの活性化を介して寄与することが報告されている1)。一方、乳癌、膀胱癌、胃癌、大腸癌などで腫瘍の進行に伴う発現の増加が報告されている。また、ビトロネクチンとの結合能を欠失した変異uPAR(uPARW32A)およびD1ドメイン欠損uPAR(uPARΔD1)を発現したHEK293細胞をSCIDマウスに移植する実験では、野生型uPARを発現した細胞に比べて腫瘍形成能が低下している2)。これらの結果よりuPARが腫瘍の浸潤・転移に寄与し、特に大腸癌では予後規定因子であることが示されている。また、急性腎障害の患者におけるsuPAR血漿濃度の上昇、およびsuPAR過剰発現マウスでの腎機能異常と抗suPAR抗体による病態緩和が報告され、suPARが急性腎障害を誘導することが報告されている3)。また、COVID-19における肺損傷とその後の肺線維症に促進的に寄与することが報告されている4)。
【ノックアウトマウスの表現型】
uPAR遺伝子欠損マウスでは、大脳皮質の介在性抑制ニューロンの減少とそれに伴う痙攣誘発性の亢進、造血幹細胞の骨髄から血液中への動員の低下、内皮間葉転換制御および血管周囲繊維症の亢進5)、ブレオマイシンによって誘導される肺線維症の亢進4)が報告されており、これらの病態形成においてuPARの寄与が示唆されている。また、卵巣癌の移植においてuPAR遺伝子欠損マウスでは野生型対照マウスにくらべて腫瘍形成が遅延し、生存日数も延長することから、ホストのuPARが腫瘍形成に促進的に寄与することが示されている6)。
図表
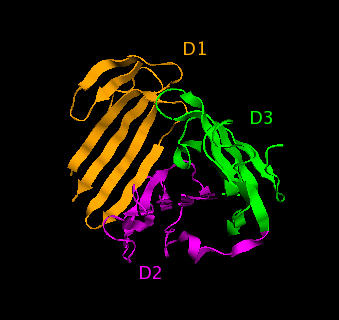
uPARの構造(D1-3はドメインを示す)
引用文献
1)(Wei C, El Hindi S, Li J, Fornoni A, Goes N, Sageshima J, Maiguel D, Karumanchi SA, Yap HK, Saleem M, Zhang Q, Nikolic B, Chaudhuri A, Daftarian P, Salido E, Torres A, Salifu M, Sarwal MM, Schaefer F, Morath C, Schwenger V, Zeier M, Gupta V, Roth D, Rastaldi MP, Burke G, Ruiz P, Reiser J: Circulating urokinase receptor as a cause of focal segmental glomerulosclerosis. Nat Med 17: 952-960, 2011.
2) Pirazzoli V, Ferraris GM, Sidenius N: Direct evidence of the importance of vitronectin and its interaction with the urokinase receptor in tumor growth. Blood 121: 2316–2323, 2013.)
3)Hayek SS, Leaf DE, Samman Tahhan A, Raad M, Sharma S, Waikar SS, Sever S, Camacho A, Wang X, Dande RR, Ibrahim NE, Baron RM, Altintas MM, Wei C, Sheikh-Hamad D, Pan JS, Holliday MW Jr, Januzzi JL, Weisbord SD, Quyyumi AA, Reiser J: Soluble Urokinase Receptor and Acute Kidney Injury. N Engl J Med 382: 416-426, 2020.
4)Shmakova AA, Popov VS, Romanov IP, Khabibullin NR, Sabitova NR, Karpukhina AA, Kozhevnikova YA, Kurilina EV, Tsokolaeva ZI, Klimovich PS, Rubina KA, Vassetzky YS, Semina EV. Urokinase System in Pathogenesis of Pulmonary Fibrosis: A Hidden Threat of COVID-19. Int J Mol Sci. 24: 1382, 2023.
5) Dergilev KV, Beloglazova IB, Tsokolaeva ZI, Vasilets YD. Deficiency of Urokinase-Type Plasminogen Activator Receptor Is Associated with the Development of Perivascular Fibrosis in Mouse Heart. Bull Exp Biol Med 173: 5-9, 2022.
6) Al-Hassan NN, Behzadian A, Caldwell R, Ivanova VS, Syed V, Motamed K, Said NA: Differential roles of uPAR in peritoneal ovarian carcinomatosis. Neoplasia 4: 259-70, 2012.
参考文献
1) Blasi F, Sidenius N: The urokinase receptor: focused cell surface proteolysis, cell adhesion and signaling. FEBS Lett 584: 1923-1930, 2010.
2)窓岩清治 がんと線溶(臨床) 日本血栓止血学会誌; 33巻3 号:321-328, 2022.
