- 大分類
-
- 凝固
- 小分類
-
- 病態
ヘパリンコファクターII欠乏症・異常症 heparin cofactor II deficiency and abnormality
解説
1) 概念と病態
ヘパリンコファクターⅡ (heparin cofactor Ⅱ: HCⅡ)は分子量65.6kDの一本鎖糖蛋白であり、アンチトロンビン(AT)とともにserine protease inhibitor (serpin)に分類される。HCⅡはSERPIND1遺伝子でコードされており、HCⅡ蛋白は肝細胞で合成後に流血中に分泌され、末梢血中ではおおよそ80μg/ml (1μM)の濃度で循環している1,2。またHCⅡ蛋白の血漿中の半減期はおおよそ48-72 時間である。
HCⅡは主に血管内皮下の血管平滑筋細胞や線維芽細胞が存在するいわゆる血管外組織において、トロンビンを主として特異的に阻害する1,2。HCⅡ欠乏症患者では、これまで静脈血栓症の発症報告がなされているが3,4、血管内の流血中におけるトロンビン阻害作用はATに比べるとはるかに弱いため(流血中のトロンビン活性阻害の80%程度はATが担っているとされる)、真の血栓症のリスクとなるか否かについては、議論の余地が残されている。一方、HCⅡは血管平滑筋細胞や線維芽細胞にて産生・分泌されるデルマタン硫酸と協調し、トロンビンとの3者で複合体を形成することで、トロンビン–トロンビン受容体 (protease-activated receptors (PAR-1やPAR-2など))系の活性化を阻害する5,6。トロンビンは、加齢や脂質異常症・糖代謝異常、高血圧症などでダメージを受けた血管内皮を通過し、血管平滑筋細胞層や線維芽細胞の存在するマトリックスに容易に浸透・浸潤するため、HCⅡはこの傷害血管壁におけるトロンビン作用を、効果的に阻害しうる唯一の内因性防御因子として重要な役割を担っている(図1)。
Tollefsenらのグループが作成したHCⅡホモ欠損マウスは、メンデルの法則通りに出生し、外観では野生型マウスとの差異がなく、また寿命短縮も呈さなかったが、頸動脈内皮障害を誘導した後の血栓形成による血管閉塞時間の短縮を認めた。筆者らが作成したノックアウトマウスを用いた解析では、HCⅡホモ欠損で胎生致死、ヘテロ欠損で心血管リモデリング異常や血管新生障害を来した7-9。また我々は、ヒトにおける血漿HCⅡ活性の低下は冠動脈形成術後のステント内再狭窄10や頸動脈硬化11、閉塞性動脈硬化症12、心筋リモデリング異常の発症増加に寄与することを報告してきた8。他のグループからも血漿HCⅡ活性の低下は血管内皮機能の低下や下肢動脈のステント留置後再狭窄のリスク因子である報告がなされている13,14。
また我々のグループでは、血漿HCⅡ活性が、ヒトの空腹時血糖値やインスリン抵抗性指標 (Homeostatic Model Assessment for Insulin Resistance: HOMA-IR)と負の相関を示し、HCⅡヘテロ欠損マウスでも高脂肪食投与により、脂肪細胞サイズの増大およびマクロファージの浸潤増大を伴ったインスリン抵抗性の悪化と肝における糖新生亢進を呈することを報告した15。加えて我々は、糖尿病患者を対象とした臨床研究において、血漿HCⅡ活性が、随時尿のアルブミン・クレアチニン比 (ACR)ならびに年間ACRの増加量と負の相関を示すことに加え、代謝機能障害関連脂肪性肝疾患 (Metabolic dysfunction Associated Steatotic Liver Disease: MASLD) における肝臓線維化指標(Fibrosis-4 index: Fib-4 index, NAFLD Fibrosis Score: NFS, Aspartate aminotransferase to Platelet Ratio Index: APRI)と独立した負の相関を示すことも明らかにした16,17。この様の結果からは、HCⅡはいわゆる肥満・糖尿病・脂質異常症。高血圧症などの代謝機能障害疾患患者における多臓器障害に対して、包括的な臓器保護効果を発揮していることが想定される(図2)。
2) 疫学
ヘテロ異常症は一般人口の1%程度存在するとされている。我々が検討した範囲でも、おおよそ100人に1人程度に血漿HCⅡ活性が50%程度に低下したヘテロ異常症と思われる症例が見られる。ホモ異常症は理論上4万人に1人存在するが、ヒトのホモ異常症の報告症例もHCⅡ活性の完全欠損ではないため18、ホモ完全欠損症はヒトでも胎生致死の可能性がある。
3) 検査法と診断
検査はクエン酸血漿検体を用いる。抗原量は正常でも活性の低下した分子異常症の症例も存在するため、血漿HCⅡ活性の測定が望ましい。現在国内では、コマーシャルベースでの測定を行っている機関がないため、デルマタン硫酸及びトロンビンを用いた合成基質法の測定キットを使用する必要がある(STACHROM® HCⅡ, Stago)。まず、健常者のクエン酸血漿プールをコントロールとして血漿HCⅡ活性の標準検量線を作成し、対象被験者の血漿HCⅡ活性を決定する。血漿HCⅡ活性には一般的に性差はないが、加齢とともに徐々に低下する。血漿HCⅡ活性は、日本人の60-69歳で、健常コントロールに対して概ね80-120%程度が標準値となる。ヘテロ欠乏症はおおよそ40-60%程度の活性値である。粥状動脈硬化疾患を呈しやすい症例、糖尿病患者における顕性アルブミン尿の増加や代謝異常関連脂肪性肝疾患(MASLD)における進行肝線維症の症例ではおおよそ血漿HCⅡ活性が80%未満の場合に多く見られる。尚、血漿HCⅡ活性は甲状腺ホルモン動態の影響を正に受けるため、甲状腺機能低下症患者では低下している。逆にバセドウ病の様な甲状腺ホルモン過剰状態では、活性値が高値となる。そのため、真の血漿HCⅡ活性の評価には、甲状腺機能も併せて評価しておく必要がある。
4) 治療と予後
静脈血栓症に関しては、若年者で心血管系リスクを有さず、かつ既往歴にこれまでに静脈血栓症がなければ、生活習慣指導などを行った上で経過観察が原則となる。静脈血栓症を発症した場合の抗凝固療法には明らかな予防治療に関するエビデンスはないが、血漿HCⅡ活性が50%未満のヘテロ異常症が強く疑われる場合は、ワーファリンや直接作用型経口抗凝固薬(direct oral anticoagulant: DOAC)をリスク・ベネフィットを十分検討した上で投与を考慮する。
一方、動脈硬化症に関しては、65歳以上で血漿HCⅡ活性が80%未満の患者では、高血圧、脂質異常症、糖尿病、喫煙などの心血管リスクが重積した場合、進行性の動脈硬化性疾患をきたしやすいため、各リスク因子の管理を厳重に行い、必要に応じて、降圧治療の強化に加え、抗血小板薬や、スタチン、EPA製剤などの投与を検討する。また糖尿病患者においては、血漿HCⅡ活性低値例では、アルブミン尿の増加による糖尿病関連腎臓病や肝線維化の進行が危惧されるため、血糖管理の厳格化とともに治療薬剤としては、肝腎保護効果を考慮し、SGLT2阻害薬やGLP-1(GIP/GLP-1)受容体作動薬の使用も優先的に考慮すべきである。
図表
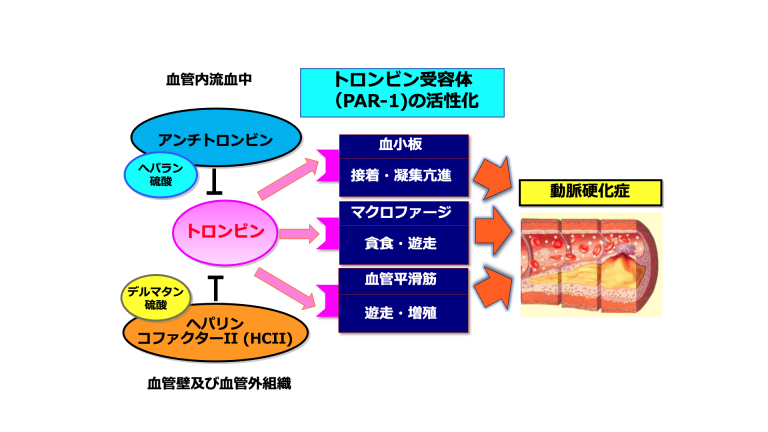
図1. トロンビン受容体の活性化と動脈硬化 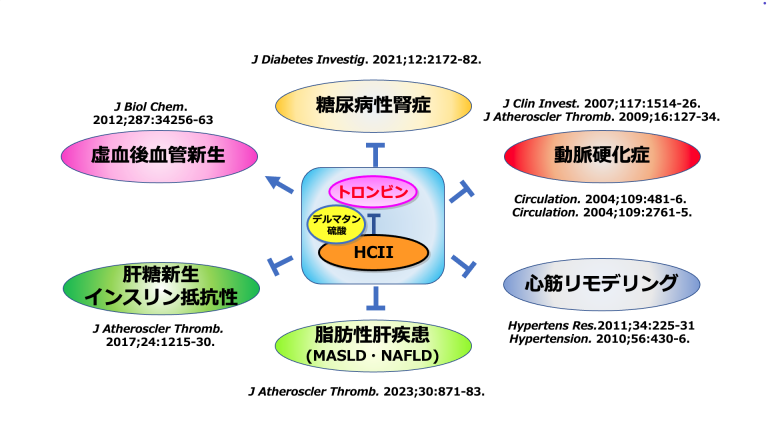
図2. 多彩なHCIIの臓器保護効果
引用文献
1. Tollefsen DM. Insight into the mechanism of action of heparin cofactor II. Thromb Haemost. 1995;74:1209-1214.
2. Tollefsen DM. Heparin cofactor II deficiency. Arch Pathol Lab Med. 2002;126:1394-1400.
3. Tran TH et al. Association of hereditary heparin co-factor II deficiency with thrombosis. Lancet. 1985;2:413-414.
4. Sie P et al. Constitutional heparin co-factor II deficiency associated with recurrent thrombosis. Lancet. 1985;2:414-416.
5. Aihara K. Heparin cofactor II attenuates vascular remodeling in humans and mice. Circ J. 2010;74:1518-1523.
6. Aihara K et al. Heparin cofactor II as a novel vascular protective factor against atherosclerosis. J Atheroscler Thromb. 2009;16:523-531.
7. Aihara K et al. Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice. J Clin Invest. 2007;117:1514-1526.
8. Sumitomo-Ueda Y et al. Heparin cofactor II protects against angiotensin II-induced cardiac remodeling via attenuation of oxidative stress in mice. Hypertension. 2010;56:430-436.
9. Ikeda Y et al. Heparin cofactor II, a serine protease inhibitor, promotes angiogenesis via activation of the AMP-activated protein kinase-endothelial nitric-oxide synthase signaling pathway. J Biol Chem. 2012;287:34256-34263.
10. Takamori N et al. High plasma heparin cofactor II activity is associated with reduced incidence of in-stent restenosis after percutaneous coronary intervention. Circulation. 2004;109:481-486.
11. Aihara K et al. Heparin cofactor II is a novel protective factor against carotid atherosclerosis in elderly individuals. Circulation. 2004;109:2761-2765.
12. Aihara K et al. Heparin cofactor II is an independent protective factor against peripheral arterial disease in elderly subjects with cardiovascular risk factors. J Atheroscler Thromb. 2009;16:127-134.
13. Huang PH et al. Decreased heparin cofactor II activity is associated with impaired endothelial function determined by brachial ultrasonography and predicts cardiovascular events. Int J Cardiol. 2007;114:152-158.
14. Schillinger M et al. High plasma heparin cofactor II activity protects from restenosis after femoropopliteal stenting. Thromb Haemost. 2004;92:1108-1113.
15. Kurahashi K et al. The Role of Heparin Cofactor in the Regulation of Insulin Sensitivity and Maintenance of Glucose Homeostasis in Humans and Mice. J Atheroscler Thromb. 2017;24:1215-1230.
16. Hara T et al. Plasma heparin cofactor II activity is inversely associated with albuminuria and its annual deterioration in patients with diabetes. J Diabetes Investig. 2021;12:2172-2182.
17. Hara T et al. Plasma Heparin Cofactor II Activity Is Inversely Associated with Hepatic Fibrosis of Non-Alcoholic Fatty Liver Disease in Patients with Type 2 Diabetes Mellitus. J Atheroscler Thromb. 2023;30:871-883.
18. Villa P et al. Hereditary homozygous heparin cofactor II deficiency and the risk of developing venous thrombosis. Thromb Haemost. 1999;82:1011-1014.
参考文献
日本臨牀 2024年 別冊領域別症候群シリーズNo.30 「血液症候群(第3版)V」
