- 大分類
-
- 凝固
- 小分類
-
- 分子
アンチトロンビン(AT) antithrombin(AT)
解説
【概要】
アンチトロンビン(AT)は、肝臓で合成され血漿中には15-31mg/dL存在する分子量58,000の一本鎖糖タンパク質で、その血中半減期は60-70時間である。プロテアーゼインヒビターによる凝固制御系において中心的な役割を果たすセリンプロテアーゼインヒビター(SERPIN)の一員である。トロンビンのほかFXa、FXIa、FXIIa、カリクレインなどほとんどの活性型凝固因子に対して阻害活性を有するが、血漿中には他のSERPINも共存しており、ATは主にトロンビン、FXa、FXIaの制御に働いていると考えられる。アンチトロンビンIII(ATIII)と同一分子である。
【構造と機能】
AT成熟タンパク質は432アミノ酸残基で構成され、セリンプロテアーゼとの反応部位はC末端領域の反応ループ内に存在するArg393-Ser394である。反応部位が基質として切断される際にArg393が標的セリンプロテアーゼの活性Serとアシル結合を形成することによりその活性を阻害する自殺型インヒビターである。しかし、Arg393の側鎖は分子の内側を向いているため標的セリンプロテアーゼとの反応速度は遅い。一方、N末端領域にあるヘパリン結合領域にヘパリン類(未分画〈高分子〉ヘパリン、低分子量ヘパリン、ペンタサッカライド、ヘパラン硫酸)が結合するとATは動的な構造変化を起こしArg393の側鎖が分子の外側を向くようになり反応速度が格段に早くなる。ATによるトロンビンの不活化の際にはヘパリンはトロンビンにも結合しそれらの橋渡しをすることによっても不活化が促進される。低分子ヘパリンやペンタサッカライドは未分画ヘパリンに比してトロンビン不活化能が弱い。FXaの不活化の際にはヘパリン類はATのみに結合し不活化を促進する。
【ノックアウトマウスの表現形】
ホモ接合体のノックアウトマウスは胎生16.5日には広範な皮下出血を来たし死亡すると報告されている。
【病態との関わり】
先天性AT欠損症、先天性AT異常症、肝機能障害、新生児では肝が未発達のため低値を示す。凝固亢進により消耗性に低値を示すと考えられる。敗血症性播種性血管内凝固症候群(DIC)で低下しやすいが、急性前骨髄球性白血病では低下しない症例もある。ヘパリン類が抗凝固活性を示すにはATが必須である。臨床検査においてATはヘパリン存在下での抗Xa活性あるいは抗トロンビン活性として測定される。新規経口抗凝固薬のうち経口活性化凝固第X因子阻害薬(Xa阻害薬)は抗Xa活性測定法で、経口トロンビン阻害薬は抗トロンビン活性測定法で偽高値の原因となる。
図表
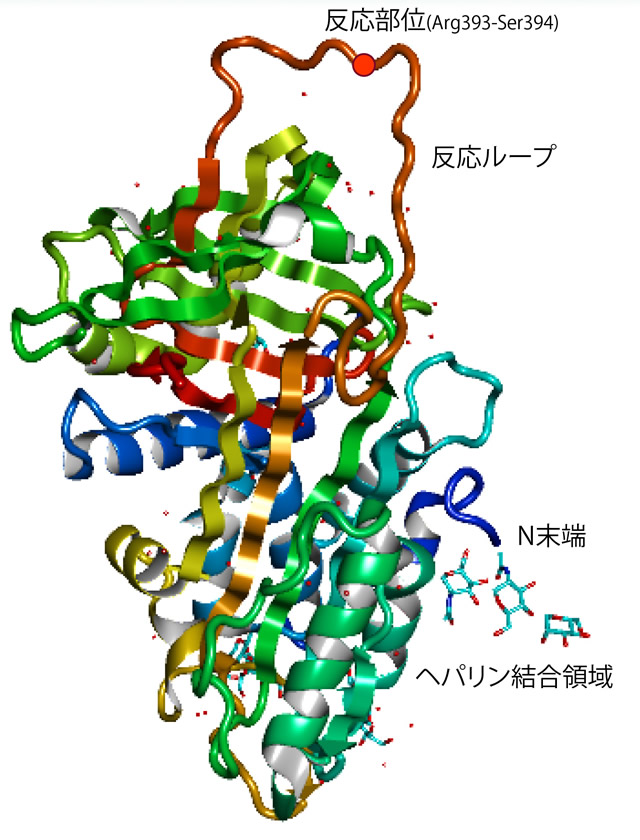
図 アンチトロンビン(日本蛋白質構造データバンク(PDBj)より引用)
引用文献
1) 日本蛋白質構造データバンク(PDBj)http://pdbj.org/
参考文献
1) アンチトロンビンの構造と機能,血栓止血誌 25:23-25,2014.
2) アンチトロンビンのプロテアーゼ阻害機構とヘパリンの作用機構,血栓止血誌 10:93-99,1999.
3) Complete antithrombin deficiency in mice results in embryonic lethality J. Clin. Invest 106: 873-878, 2000.
