- 大分類
-
- 凝固
- 小分類
-
- 分子
ヘパリン heparin
解説
【概要】
ヘパリンは、1916年に米国の医学生McLeanによって、イヌの肝臓から脂溶性の血液凝固を阻止する物質として分離され、その名称は肝臓のギリシャ語 “hepar” に由来する。現在、ヘパリンは豚の腸粘膜から分離され、血液抗凝固剤として、血栓塞栓症を予防する薬剤としてだけでなく、人工透析の際の血液凝固を防止する目的にも利用されている。
【構造と分子量】
ヘパリンは、ヘパラン硫酸の一種である。ヘパリン/ヘパラン硫酸は、ウロン酸(β-D-グルクロン酸およびα-L-イズロン酸:図の2, 4)とグルコサミン(D-N -アセチルグルコサミンおよびD-N -硫酸グルコサミン:図の1,3,5)の二糖が1単位となって、それらがα又はβ-1,4結合を数十から数百回繰り返した直鎖状の多糖である。分子量は鎖長の違いによって3から30kDaと様々である(平均12~15kDa)。ウロン酸の2位がO -硫酸化、グルコサミンの3位と6位がO -硫酸化されたものと、2位のアミノ基がN -硫酸化されたものがある。ヘパリンはヘパラン硫酸のなかでも、高度に硫酸化された特殊なヘパラン硫酸と見なすことができる。
【血液抗凝固作用】
ヘパリンは図の五糖配列を介して血流中のアンチトロンビン(AT)と結合し、ATが単独でトロンビンや血液凝固第X因子の活性を阻害するのを数百倍から数千倍に増強し、血液の凝固を阻害する。五糖配列のうちでも、N -硫酸グルコサミン3,6-O -二硫酸の3位硫酸残基は不可欠である。ヘパリン-AT複合体がトロンビン活性を阻害するにはヘパリンとトロンビンの相互作用も必要なため、分子量5000以上が必要であるが、第X因子活性の阻害には、ヘパリンと第X因子との相互作用は必要なく、低分子のヘパリンでよい。ヘパリンは、AT以外にヘパリンコファクターII、血小板因子IV、プロテインCインヒビターなどの血液凝固関連因子とも結合する。
【生合成とその他のポイント】
ヘパリンは、結合組織型の肥満細胞でのみ生合成され、ヒスタミンやセリグリシンと結合した複合体、または遊離した多糖として、分泌顆粒中に貯蔵されている。ヘパリンは血液中には通常分布せず、炎症部位で肥満細胞から循環血液中へ遊離する。また、ヘパリンはヒトとは異なる血液凝固機構をもつ無脊椎動物にも分布し、種々の成長因子(繊維芽細胞成長因子やヘパリン結合性上皮成長因子)、接着因子(フィブロネクチンやビトロネクチン)、代謝関連物質(リポタンパク質リパーゼやアポリポタンパク質)などと高親和性に結合する。それ故、ヘパリンの生理的役割として、血液抗凝固作用以外に炎症部位での細菌やその他の外因子からの生体防御に寄与しているのではないかと考えられている。
図表
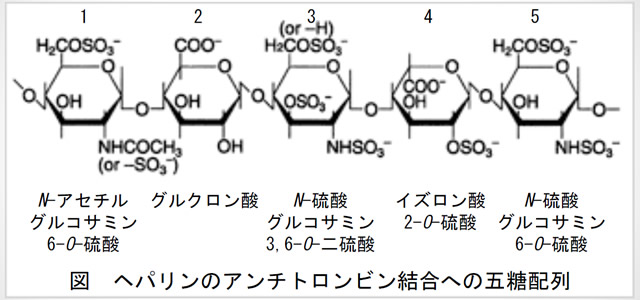
ヘパリンのアンチトロンビン結合への五糖配列
参考文献
1) 松尾耕二,佐々木啓子:ペパラン硫酸プロテオグリカン,千葉科学大学紀要,69-76,2012.
2) 石原雅之:ヘパラン硫酸の構造と機能 蛋白質核酸酵素 V0l.40 No.9,共立出版株式会社,1995.
