- 大分類
-
- 凝固
- 小分類
-
- 機構
Glaドメイン構造と凝固因子
解説
【概要】
ビタミンK依存性タンパク質(プロトロンビン、凝固第VII因子、凝固第IX因子、凝固第X因子、プロテインC、プロテインS、プロテインZ)のN末端近傍には、グルタミン酸側鎖がγ-カルボキシル化されたγ-carboxyglutamic acid (Gla)残基が9-13個存在する。このGla残基を含む45残基前後のN末端領域がGlaドメインである。
【Gla化】
グルタミン酸残基のGla化は、小胞体膜に存在するγ-glutamylcarboxylase (GCX) により触媒される。翻訳後小胞体内腔に挿入した基質タンパク質前駆体は、N末端のpropeptideを介してGCXと結合し、Glaドメインのすべてのグルタミン酸残基(Glu)がGla化されるまで、GCXとの複合体が維持される。GCXは還元型ビタミンKを必要とし、ビタミンKのエポキシド化に伴いグルタミン酸残基をGlaへと変換させる。酸化したビタミンKは、小胞体膜酵素であるビタミンKエポキシド還元酵素(VKOR)によって再び還元型となり、GCXへと供給される。経口抗凝固薬であるワルファリンはVKORによるビタミンKの還元を阻害するため、結果としてビタミンK依存性タンパク質のGla化が抑制される。
【Glaドメインの構造と機能】
【Glaドメインの構造と機能】
Glaドメインのアミノ酸配列は、ビタミンK依存性タンパク質間で相同性が高い(図1A)。Gla残基にカルシウムイオンが結合するとGlaドメインの立体構造が変化し、N末端に疎水性ループが形成される。プロトロンビンのGlaドメインについて、Glaドメインに結合したカルシウムイオンおよびGla17, Gla21と、細胞膜成分であるホスファチジルセリン(PS)のセリン頭部が結合し、さらにArg10およびArg16とPSのリン酸基が結合することにより、GlaドメインとPS特異的なリン脂質膜との結合が説明されている(図1B)。また、凝固第IX因子ではカルシウムイオンに加えてマグネシウムイオンがGlaドメインに結合し、VIIa、VIIIa、凝固第X因子との相互作用に寄与するものと考えられている。このようなGlaドメインの性質によって、ビタミンK依存性凝固因子がPSを露出した細胞膜表面にのみ局所化し、効率的かつ迅速に凝固反応が促進する。
図表
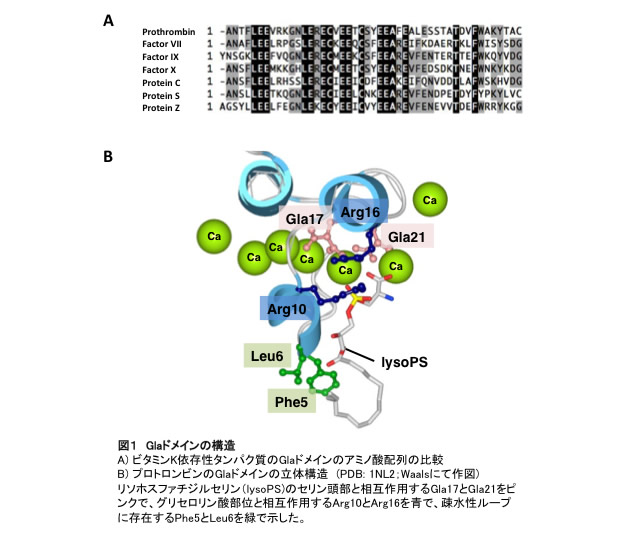
図1 Glaドメインの構造
参考文献
1) ビタミンKとワルファリン,一瀬白帝編,図説血栓・止血・血管学~血栓症制圧のために.中外医学社.
2) プロトロンビンの基礎と臨床,一瀬白帝編,図説血栓・止血・血管学~血栓症制圧のために.中外医学社.
