- 大分類
-
- 線溶
- 小分類
-
- 病態
神経系と線溶 Fibrinolytic system in the nervous system
解説
神経系における線溶の機能は多岐にわたり、神経細胞生存・死の制御、神経ネットワークの可塑性、ミクログリアの機能制御、脳血管機能/透過性制御等が挙げられる。
組織型プラスミノゲンアクチベータ(tPA)は神経細胞およびミクログリアに発現しており、神経細胞では神経終末および樹状突起より分泌されると考えられている。脳では海馬、辺縁体、小脳(プルキンエ細胞)の発現が多く、脊髄でも発現している。tPAの作用は、プラスミンの活性化を介する反応、プラスミン以外の基質を活性化する反応、レセプターへの結合による反応の3つに大別される。プラスミン以外の基質としては血小板由来成長因子(PDGF-CC), ミクログリア遊走因子(MCP-1) が、tPAのレセプターとして、NメチルDアスパラギン酸(NMDA)型グルタミン酸受容体サブユニットA、B、D、リポタンパク受容体関連タンパク1(LRP1)、アネキシンA2が報告されている。tPAの作用機序、発現する細胞種、制御する細胞機能を表に示す。このうち、神経細胞の生存/死に対するtPAの作用については、多くの相反する知見が報告されている。さらに、tPAは心的外傷後ストレス障害(PTSD)や総合失調症に関連することが報告されている。
tPAのインヒビターとして、神経系ではプラスミノゲンアクチベーターインヒビター1(PAI-1)プロテアーゼネキシン1 が機能している。また、PAI-1は神経細胞あるいはグリア細胞において発現し、tPAの阻害を介して神経機能の制御に寄与している。
プラスミンは神経栄養因子であるBDNF、およびミクログリア遊走因子(MCP1)の活性化を介して神経ネットワークの可塑性、記憶、ミクログリアの集積を制御している。また神経細胞の足場として生存に必須な細胞外マトリックスであるラミニンの分解を通じて、細胞の生存の制御を行っている。また、傷害部位に沈着したフィブリンは末梢神経の再生阻害し、プラスミンはその分解を介して末梢神経再生を促進する。一方、α2プラスミンインヒビター(α2アンチプラスミン)は海馬や大脳皮質に発現し、プラスミンの阻害を介して記憶の制御に寄与する1)。
アルツハイマー病において、プラスミンはβアミロイド(Aβ)分解を介して神経の変性に抑制的に寄与する2)。また、フィブリンがミクログリアの活性化を介してアルツハイマー病を増悪することから、プラスミンはAβに加えてフィブリンの分解を介してアルツハイマー病を抑制する可能性も示唆されている。一方、末梢神経傷害を伴うトランスサイレチンアミロイドーシスはプラスミンにより促進される可能性が指摘されている3)。
中枢神経系においてウロキナーゼ型プラスミノゲンアクチベーター(uPA)は神経細胞およびオリゴデンドロサイトに発現し、uPA受容体(uPAR)に結合する。uPAはプラスミノゲンの活性化を行うとともに、プラスミン活性化を介さず神経新生、神経の移動に寄与する。また脳梗塞後の一過性のシナプス変性に対し、シナプスの再構築を細胞接着分子のNカドヘリンを介したメカニズムにより促進する4)。
図表
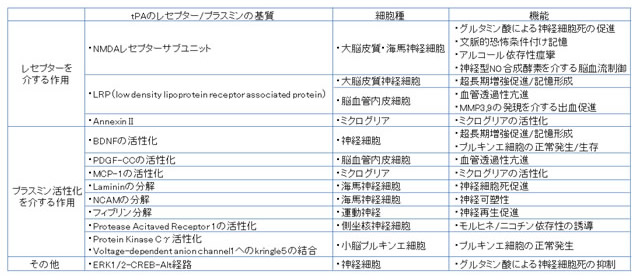
表 tPAのレセプターとプラスミンの基質、ターゲットの細胞種、制御する細胞機能
引用文献
1) Eri Kawashita, Keiichi Ishihara, Haruko Miyaji, Yu Tanishima, Akiko Kiriyama, Osamu Matsuo 3, Satoshi Akiba. α2-Antiplasmin as a potential regulator of the spatial memory process and age-related cognitive decline. Mol Brain. 2020; 13: 140.
2) H. Michael Tucker, Muthoni Kihiko, Joseph N. Caldwell, Sarah Wright, Takeshi Kawarabayashi, Douglas Price, Donald Walker, Stephen Scheff, Joseph P. McGillis, Russell E. Rydel, Steven Estus. The Plasmin System Is Induced by and Degrades Amyloid-β Aggregates.J Neurosci. 2000; 20: 3937–3946.
3) Ivana Slamova, Rozita Adib, Stephan Ellmerich, Michal R. Golos, Janet A. Gilbertson, Nicola Botcher, Diana Canetti, Graham W. Taylor, Nigel Rendell, Glenys A. Tennent, Guglielmo Verona, Riccardo Porcari, P. Patrizia Mangione, Julian D. Gillmore, Mark B. Pepys, Vittorio Bellotti, Philip N. Hawkins, Raya Al-Shawi, J. Paul Simons. Plasmin activity promotes amyloid deposition in a transgenic model of human transthyretin amyloidosis.Nat Commun. 2021; 12: 7112.
4) Ariel Diaz, Paola Merino, Patrick McCann, Manuel A Yepes, Laura G Quiceno, Enrique Torre, Amelia Tomkins, Xiaodong Zhang, Chadwick M Hales, Frank C Tong, Manuel Yepes. Urokinase-type plasminogen activator promotes N-cadherin-mediated synaptic recovery in the ischemic brain. J Cereb Blood Flow Metab. 2021;41:2381-2394.
