- 大分類
-
- 凝固
- 小分類
-
- 検査
トロンビン-アンチトロンビン複合体(TAT) thrombin-antithrombin complex(TAT)
解説
【概要】
内因系または外因系が活性化されて凝固反応が進み、共通系反応において活性化第X因子(FXa)が生じると、FXaはプロトロンビン(FII)を活性化型のトロンビンへと変換させる。このとき、プロトロンビンフラグメント1+2 (F1+2)と呼ばれるペプチドが遊離しトロンビンが生成される。トロンビンは抗凝固因子の1つであるアンチトロンビン(AT)と結合して短時間で活性を失い、トロンビン-アンチトロンビン複合体(TAT)が形成される(図)。トロンビン生成量は凝固活性化の程度を反映すると考えられているが、半減期は数秒~十数秒と極めて短い。トロンビン形成試験(TGT)などin vitroで凝固反応を活性化させてトロンビン生成量を測定する方法もあるが、in vivoでのトロンビン生成量を測定することは極めて難しい。一方、TATの半減期は数分~十数分程度と長くトロンビンの産生量と相関すると考えられるため、TAT測定によって凝固活性化の程度を把握することができ、TAT高値は凝固亢進状態を示す。なお、アンチトロンビンはトロンビンと1:1の比率で結合してトロンビンを不活化するが、ヘパリンによりその反応速度が高まることが知られている。TATは播種性血管内凝固(DIC)などの各種血栓性疾患の診断ならびに治療効果判定に用いられる。
【基準値】
3~5 ng/mL未満とすることが多いが、各測定キットの添付文書を確認すること。
【測定法・測定原理】
化学発光酵素免疫測定法(CLEIA)、ラテックス凝集法、酵素結合免疫吸着測定法(ELISA)など
【その他のポイント】
TATは採血が困難で時間を要した場合などは、組織液が混入して採血管内で凝固反応が進み高値を示すことがある。Dダイマーなどのその他の凝固活性化を示すマーカーが正常である場合には偽高値の可能性を考え、再採血を行った上での再検を考慮する。
明らかな凝固亢進がみられるにも関わらずDICなどでAT減少や機能低下をしている際にはTATが高値とならない場合がある。このような場合には可溶性フィブリン(SF)など他の凝固活性化マーカーを測定する。
図表
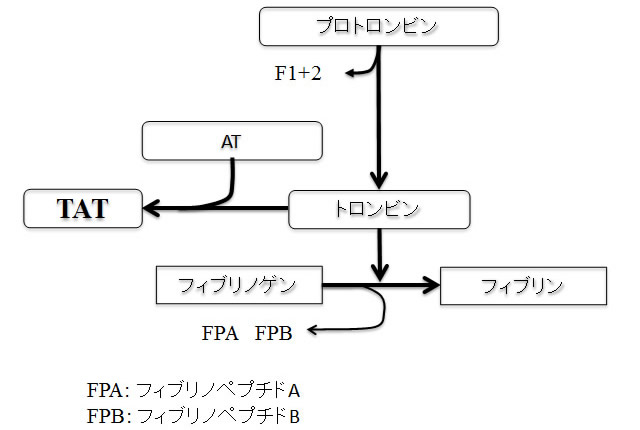
図 トロンビン-アンチトロンビン複合体(TAT)
参考文献
- 朝倉英策:2章 血栓止血関連検査 12 TAT, F1+2,朝倉英策編著,臨床に直結する血栓止血学.中外医学社,2013,57-59.
- Bauer KA. Laboratory markers of coagulation activation. Arch Pathol Lab Med. 1993;117(1):71-7.
- Pelzer H, Schwarz A, Heimburger N. Determination of human thrombin-antithrombin III complex in plasma with an enzyme-linked immunosorbent assay. Thromb Haemost. 1988;59(1):101-6.
- Griffith MJ, Lundblad RL. Dissociation of antithrombin III–thrombin complex. Formation of active and inactive antithrombin III. Biochemistry. 1981;20(1):105-10.
- Preissner KT, Zwicker L, Müller-Berghaus G. Formation, characterization and detection of a ternary complex between S protein, thrombin and antithrombin III in serum. Biochem J. 1987;243(1):105-11.
- Hirsh J, Raschke R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep;126(3 Suppl):188S-203S.
- 表美香, 吉田知孝, 朝倉英策, 御舘靖雄, 水谷朋恵, 森下英理子, 山崎雅英, 中尾眞二. ループスアンチコアグラント検査における陰性コントロール血漿の問題点 –真空採血管を用いた連続採血の検討– 血栓止血誌. 2004 15(3):278-285.
- 家子正裕, 小宮山豊, 山﨑哲, 片桐尚子, 島津千里, 内藤澄悦, 三島清司, 由木洋一, 竹内美保, 小澤達也, 熊野穣, 原田大介, 野崎順子, 田中秀明, 川合陽子, 福武勝幸, 渡邉眞一郎, 本間優. 凝固検査検体取扱いに関するコンセンサス. 日本検査血液学会雑誌. 2016 17(2): 149-157.
- Wiedermann CJ. Clinical review: molecular mechanisms underlying the role of antithrombin in sepsis. Crit Care. 2006 Feb;10(1):209.
- Chandler WL, Velan T. Estimating the rate of thrombin and fibrin generation in vivo during cardiopulmonary bypass. Blood. 2003 Jun 1;101(11):4355-62.
- Koyama K, Madoiwa S, Nunomiya S, Koinuma T, Wada M, Sakata A, Ohmori T, Mimuro J, Sakata Y. Combination of thrombin-antithrombin complex, plasminogen activator inhibitor-1, and protein C activity for early identification of severe coagulopathy in initial phase of sepsis: a prospective observational study. Crit Care. 2014 Jan 13;18(1):R13.
