- 大分類
-
- 線溶
- 小分類
-
- 病態
線溶系とアレルギー fibrinolysis and allergy
解説
1.線溶系と気管支喘息
気管支喘息は気道系の慢性炎症であり、その病態には気管支肺胞腔における凝固線溶反応が関与する1)。アレルゲン刺激を受けた肺胞上皮細胞やマクロファージ、好酸球は、組織因子を強く発現する。同時に肥満細胞から分泌されるヒスタミンなどにより血管透過性が亢進するとともに、気管支肺胞腔で血液由来の凝固因子と組織因子が接触し凝固系が活性化される。生じたトロンビンは、フィブリンを形成させるとともにアレルゲン刺激に対する感受性を高め、PAR-1を介して炎症反応をさらに亢進させる。気管支喘息でみられる反復性の炎症反応は、フィブリン沈着や細胞外マトリックス(ECM)の病的な再構築、気管支平滑筋細胞の肥大化、粘液腺細胞の増加などにより気管支壁自体の肥厚や硬化をもたらす。肥満細胞などからのplasminogen activator inhibitor-1(PAI-1)産生の増加は、プラスミン生成が抑制されマトリックスメタロプロテアーゼ(MMP)-9の活性を低下させ、気管支粘膜へのECMの沈着を促進させる2,3)。一方でプラスミノゲンを欠失させたマウスモデルでは、白血球の遊走が低下し気管支周辺領域における膠原線維の沈着や炎症部位における粘液性異形成が軽度に留まることや、抗プラスミン剤の投与により好酸球やリンパ球の浸潤、粘液産生、コラーゲン線維の沈着が抑制されることが報告されている4)。thrombin activatable fibrinolysis inhibitor (TAFI)は、補体因子C3aやC5aを不活化し気道の感受性を制御する5)。気管支喘息において線溶系は単なるプラスミン生成量の多寡にとどまらず、線溶系因子が関わる生体反応ネットワークにより病態を制御していると考えられる。
2.線溶系とアレルギー性鼻炎
アレルギー性鼻炎は、鼻粘膜下組織に好酸球の浸潤を示すI型アレルギー疾患である。マウスモデルにおいて、感作抗原に特異的なIgG1やIgE産生が増加したTh2型優位の免疫応答が誘導されるが、PAI-1の欠失によりこれらの免疫応答が解除されることから6)(図1)、PAI-1を介する線溶系の動態が、アレルギー応答を決定づける可能性がある7)。アレルギー性鼻炎の難治化には、炎症反応の慢性化に伴う組織再構築が関連する。PAI-1発現の抑制が鼻粘膜のI型およびIII型コラーゲンの沈着量を抑制させることから、炎症の慢性化にもPAI-1による線溶系の制御が重要である。
3.線溶系と慢性蕁麻疹
慢性蕁麻疹では、IgE受容体(FcγRIやFcγRII)に対する自己抗体が生じるために、補体系の活性化を介した肥満細胞の脱顆粒と、好酸球の活性化による炎症性サイトカインの放出、組織因子の発現により凝固系が活性化される8)。線溶系が作動しフィブリン分解が起こるが、臨床的にDダイマーが慢性蕁麻疹の活動性と相関し治療の指標となる9)。
図表
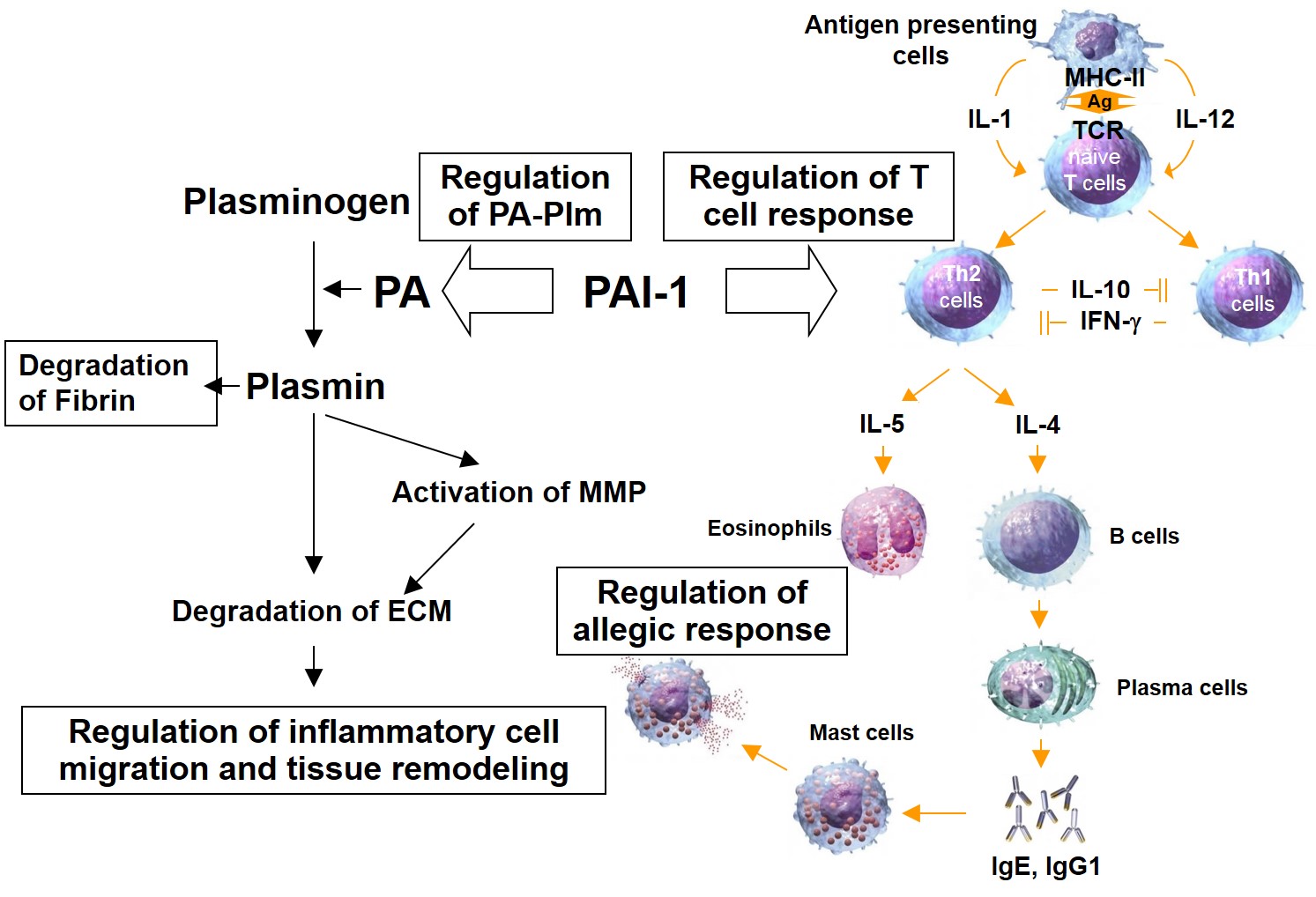
図 アレルギーと線溶
引用文献
1) de Boer JD, Majoor CJ, van ‘t Veer C, Bel EH, van der Poll T: Asthma and coagulation. Blood 119: 3236
2) Oh CK, Ariue B, Alban RF, Shaw B, Cho SH: PAI-1 promotes extracellular matrix deposition in the airways of a murine asthma model. Biochem Biophys Res Commun 294: 1155
3) Kowal K, Zukowski S, Moniuszko M, Bodzenta-Lukaszyk A: Plasminogen activator inhibitor-1 (PAI-1) and urokinase plasminogen activator (uPA) in sputum of allergic asthma patients. Folia histochemica et cytobiologica / Polish Academy of Sciences, Polish Histochemical and Cytochemical Society 46: 193-8, 2008.
4) Swaisgood CM, Aronica MA, Swaidani S, Plow EF: Plasminogen is an important regulator in the pathogenesis of a murine model of asthma. Am J Respir Crit Care Med 176: 333
5) Fujiwara A, Taguchi O, Takagi T, D’Alessandro-Gabazza CN, Boveda-Ruiz D, Toda M, Yasukawa A, Matsushima Y, Miyake Y, Kobayashi H, Kobayashi T, Gil-Bernabe P, Naito M, Yoshida M, Morser J, Takei Y, Gabazza EC: Role of thrombin-activatable fibrinolysis inhibitor in allergic bronchial asthma. Lung 190: 189
6) Sejima T, Madoiwa S, Mimuro J, Sugo T, Ishida T, Ichimura K, Sakata Y: Expression profiles of fibrinolytic components in nasal mucosa. Histochem Cell Biol 122: 61
7) Gyetko MR, Sud S, Chensue SW: Urokinase-deficient mice fail to generate a type 2 immune response following schistosomal antigen challenge. Infect Immun 72: 461
8) Tedeschi A, Kolkhir P, Asero R, Pogorelov D, Olisova O, Kochergin N, Cugno M: Chronic urticaria and coagulation: pathophysiological and clinical aspects. Allergy 69: 683
9) Asero R: D-dimer: a biomarker for antihistamine-resistant chronic urticaria. J Allergy Clin Immunol 132: 983
