- 大分類
-
- 血小板
- 小分類
-
- 機構
カルシウム流入機構 mechanism of calcium influx
解説
細胞内カルシウム(Ca2+)の上昇は細胞内のセカンドメッセンジャーとして働き,血小板の形態変化,顆粒放出,インテグリンαIIb/β3の活性化といった血小板機能発現に必須の役割を担っている.血小板細胞内カルシウムの上昇機構は,1)受容体を介した刺激によって細胞内貯蔵庫である小胞体からの放出,2)それをトリガーとした細胞膜のカルシウムチャネルの開放(store-operated calcium entry; SOCE),3)それ以外の経路(non-SOCE)が考えられている.
1)細胞内貯蔵庫からのカルシウム放出
血小板には3種のホスホリパーゼC(PLCβ,γ,δ)が発現しており,特に発現量の多いPLCβ2/3はアデノシン二リン酸(ADP)受容体(P2Y1)などのGタンパク質共役受容体のGqにより制御される.一方,PLCγ2はGPVI,インテグリンなどのチロシンリン酸化を介した刺激伝達系によって活性化を受ける.活性化PLCはホスフォイノシタイド二リン酸 (PIP2)からイノシトール三リン酸(IP3)とジアシルグリセロール(DAG)を産生し,このIP3が小胞体膜上に発現するカルシウムチャネル型のIP3受容体(IP3-R1~3)に作用すると小胞体から細胞質内にカルシウムが放出される.
2)SOCE
SOCEにはstromal interaction molecule1(STIM1)およびOrai1の二つの遺伝子が関わっている.小胞体膜に存在するSTIM1は小胞体内部位にカルシウム結合部位を持ち,カルシウムセンサーとして働く.放出により小胞体内のカルシウム濃度が低下すると,カルシウムとの結合が断たれたSTIM1は小胞体膜と細胞膜の接合部に移動し,カルシウムチャネルであるOrai1に結合してチャネルを開き,細胞外からカルシウム流入を促す.STIM1およびOrai1欠損マウス血小板では,SOCEによる細胞内Ca2+濃度の上昇は起こらなかったが,コラーゲン刺激による血小板凝集や顆粒放出のみ障害されており,アデノシン二リン酸(ADP)やトロンビンなどのGタンパク共役受容体刺激によるこれらの機能は野生型と同等であった.一方,in vivoでの機能解析では,出血時間の延長は一部の個体で見られる程度で止血機能の低下は軽度であったが,脳梗塞モデルなどでの病的血栓形成能は著明に低下しており,野生型と比べ脳梗塞の範囲は著しく狭く,脳梗塞後の脳出血のリスク上昇も認めなかった.また,Orai1のR93W変異はヒト重度複合免疫異常症(SCID)の原因遺伝子として,マウスSTIM1のD84G変異はSTIM1のgain-of-functionにより血小板減少と出血症状を起こす事が知られている.
3)non-SOCE
P2X1は細胞膜に存在するCa2+チャネル型受容体で, ATPが作用するとチャネルが開きCa2+が流入する.P2X1欠損血小板では,低濃度のコラーゲンに対する凝集が障害されていたが,高濃度のコラーゲンや他のGタンパク共役受容体刺激による凝集には影響がなかった.しかし,高ずり応力下の血栓形成が障害されており,コラーゲンとエピネフリン投与による血栓塞栓症での死亡率が低下していた.
4)その他
Transient receptor potential channels(TRPCs)のうちTRPC1および6もそれぞれSOCE,non-SOCEの経路で細胞内Ca2+濃度上昇を促し,血小板機能に影響を与える候補分子と考えられていたが,ノックアウトマウスの解析により否定された.ただし,TRPC6欠損マウスでは、出血時間の延長と血栓形成の遅延を起こすとの報告もある.
図表
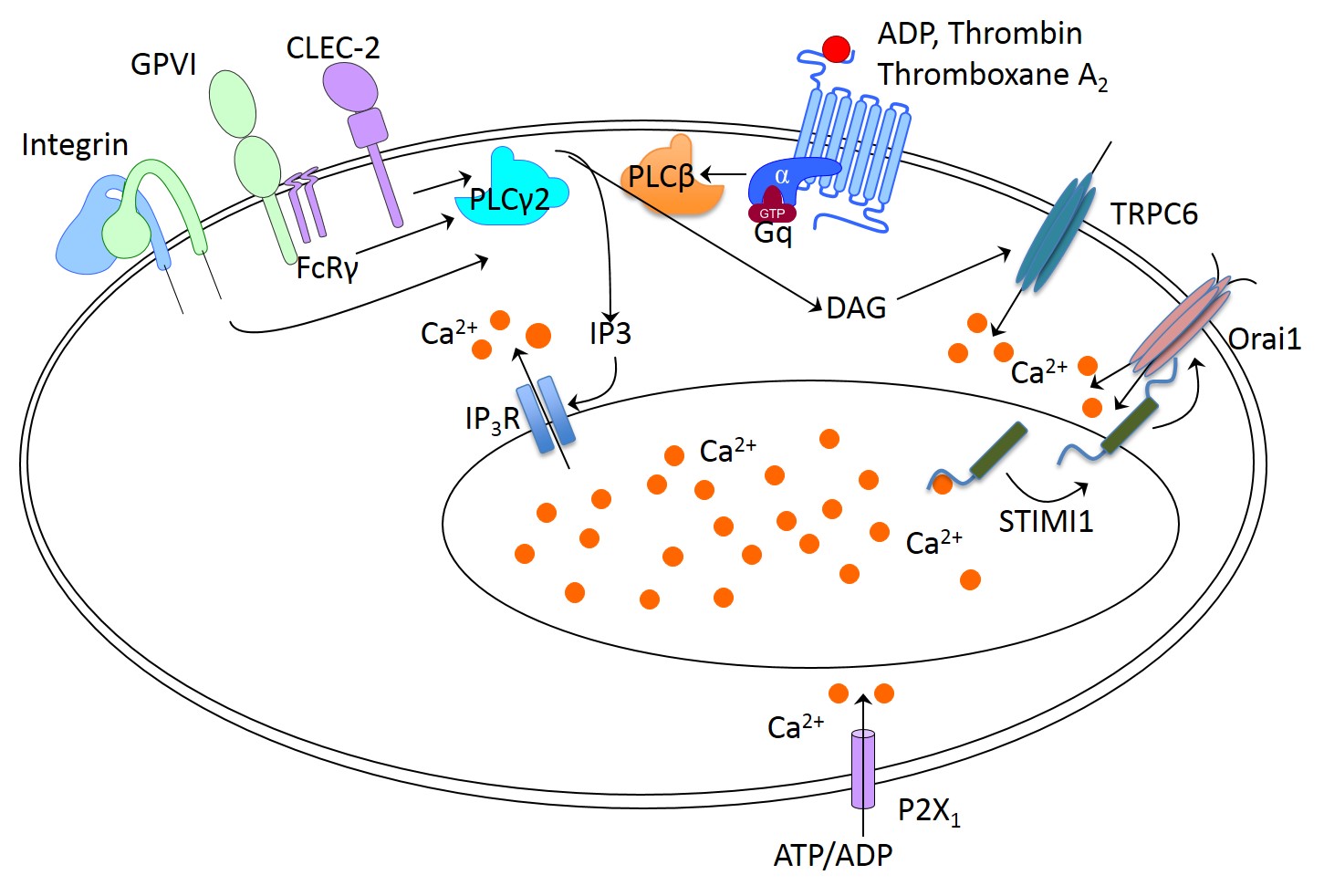
図 カルシウム流入機構(Calcium signaling in platelets)(文献1を基に作成)
参考文献
1) Varga-Szabo D, Braun A, Nieswandt B: Calcium signaling in platelets. J Thromb Haemost 7: 1057-1066, 2009.
2) Varga-Szabo D, et al.. JEM 2008; 205(7): 1583-91.
3) Braun A, et al. Blood 2009; 113(9): 2056-63.
4) Hechler B, et al. JEM 2003; 198(4): 661-7.
5) Varga-Szabo D, et al. Pflugers Arch 2008; 457(2): 377-87.
6) Ramanathan G, et al. J Thromb Haemost 2012; 10: 419-29.
7) Paez Espinosa EV, et al. Biochem Biophys Res Commun2012; 417: 853-6.
8) Albarran L, et al. Biochem Biophys Acta
