- 大分類
-
- 線溶
- 小分類
-
- 治療
周術期の線溶系と抗線溶療法 Perioperative fibrinolysis and antifibrinolytic therapy
解説
1.線溶について
線溶とは線維素溶解の略称であり、線維素とはフィブリンのことである。線溶反応とは、プラスミンによるフィブリンの分解を指す。先行するフィブリン血栓形成に対し、それを分解しようと活性化される反応を二次線溶と呼び、フィブリン産生とは関連なく、何らかの原因でプラスミン産生が亢進した状態を一次線溶と呼ぶ。臨床上は一次線溶と二次線溶は混在しうる病態であり、明確に区別することは困難だが、周術期の線溶では二次線溶が主体である。
2.周術期の線溶
線溶の主体であるプラスミンは、主に組織型プラスミノゲンアクチベータ(tPA:tissue type plasminogen activator)によって、プラスミンの前駆体であるプラスミノゲンから産生される。プラスミノゲンの血漿中濃度は約2 µM、t-PAは約70 pMであり、血栓(フィブリン)が存在しない状態での両者の反応のミカエリス定数は65 µMと高いため、液相中でプラスミンが産生されることはほとんどない。血管損傷が生じると、損傷部位でフィブリン血栓が生じるとともに、周囲の血管内皮細胞からtPAが放出され、tPAの局所濃度が上昇する。さらに、プラスミノゲンとtPAはリジン残基に対して高い親和性を持つため、血管損傷部位に生じたフィブリン分子中のリジン残基を標的として両者がフィブリン分子上に集合し、フィブリン血栓上で効率よくプラスミン産生が生じる。フィブリンやフィブリノゲンの分解産物であるDダイマーやフィブリン分解産物(FDP: fibrin/fibrinogen degradation products)の上昇を線溶亢進と表現することは多いが、術後のDダイマーやFDPの上昇は不要となった血栓を分解する正常な反応によって生じたものであり、必ずしも病的ではない。
3.病的線溶をきたしやすい病態
プラスミンによるフィブリン分解が病的(止血異常)となるか否かは、線溶制御因子とのバランスに依存する。プラスミン産生が亢進しても、線溶制御因子によってコントロールされている限り病的な線溶亢進は生じない。周術期の病的線溶の多くはプラスミン活性に対しα2プラスミンインヒビター(α2-PI)活性が低下した状態で生じ、フィブリン・フィブリノゲン分解による出血傾向となる。大量出血では輸液による希釈や消費性に、大動脈瘤では瘤内血栓による消費性にα2-PI活性が低下し、病的な線溶亢進へと傾く。産科出血の中でも、常位胎盤早期剥離や羊水塞栓など胎盤組織が母体の血中に流入する疾患では急激な凝固亢進に呼応して全身性にプラスミン活性が亢進し、α2-PIが短時間で消費され線溶亢進型のDICを来しやすい。心臓外科手術で使用される人工心肺装置は回路内を晶質液などで充填しているため、人工心肺の開始と同時に患者血液は希釈され、凝固因子だけでなくアンチトロンビンやα2-PI活性も希釈性に低下する。人工心肺中は未分画ヘパリンを投与し抗凝固を行っているが、ヘパリンによる抗凝固はトロンビン産生を完全に抑制することが出来ず、肉眼的な血栓を認めない状況であってもフィブリンを生じ、それに伴ってプラスミン産生も進行する(1)。このプラスミン産生とα2-PIのバランスが破綻すると病的線溶による止血困難に至る。人工心肺前と人工心肺離脱直後のトロンボエラストグラフの波形を比較すると、人工心肺前は正常波形であるにもかかわらず、離脱後は波形が尻つぼみとなり線溶亢進による血栓分解が生じていることがみてとれる(図1)
4.抗線溶療法
トラネキサム酸はリジンに類似した構造を持っており、プラスミノゲンのリジン結合部位に結合し、フィブリンへの結合を阻害することによってフィブリン血栓上でのプラスミン産生を抑制する。トラネキサム酸の効果は必ずしも血中濃度に依存せず、投与量・投与方法は疾患や術式によって異なるが、腎排泄なので腎機能低下例では血中濃度の上昇に留意が必要である。産後出血や外傷、人工心肺を使用する心臓外科手術ではトラネキサム酸の早期投与が推奨されているが、大量投与による術後痙攣に注意する必要がある(2,3)。
図表
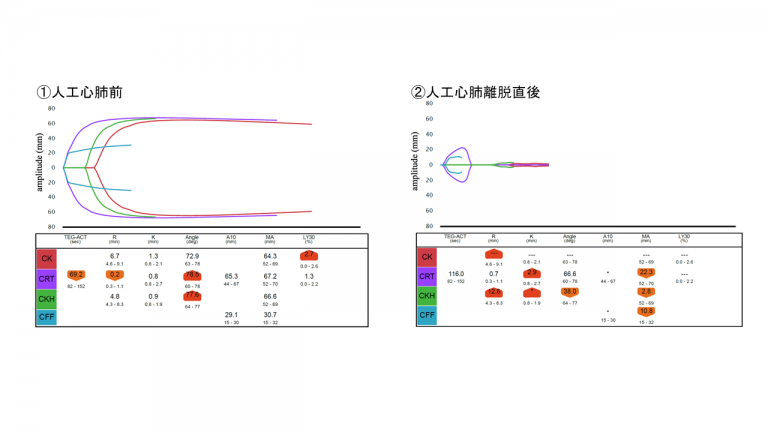
人工心肺前後のトロンボエラストグラフ
引用文献
- J Anesth 2010; 24: 96-106.
- J Clin Anesth 2022; 78: 110654.
- Seizure 2016; 36: 70-3.
