- 大分類
-
- 凝固
- 小分類
-
- 分子
プロテインC protein C
解説
1)分子量、半減期、血中濃度
分子量は約62 kDa。プロテインC(PC)の85%は軽鎖と重鎖がジスルフィド結合した二本鎖構造をとり、15%は一本鎖PCとして血中を循環する。半減期は6〜8時間。血中濃度は65 nmol/L(約4 µg/mL)。PCは肝臓で合成される。
2)機能
PCはトロンボモジュリンに結合したトロンビンによりArg169で切断され、活性化PC(APC)に変換される。その際、血管内皮細胞上にある血管内皮細胞PC受容体(endothelial PC receptor, EPCR)はPCの活性化を促進する。生成したAPCは抗凝固活性と細胞保護作用を示す。APCの抗凝固活性は、活性化凝固第V因子(FVa)のArg306、Arg506、Arg679の切断、および活性化凝固第VIII因子(FVIIIa)のArg336とArg562の切断によるそれぞれの因子の不活化で説明される。FVaの不活化では、APCはまずFVaのArg506を切断し次いでArg306を切断するが、Arg506の切断に伴うFVa活性低下は小さい。FVaの不活化にはArg306の切断が必要とされ、プロテインSはAPCによるこの切断を促進する。APCによる第IXa因子(FIXa)–FVIIIa複合体中のFVIIIaの切断不活化では、プロテインSとFVの2つの因子が要求される。APCによるFVaとFVIIIaの不活化によりトロンビンの形成が抑制され凝固系が負に制御される。
APCは虚血性脳卒中や外傷性脳損傷など、様々な疾患に対して保護作用を示す。APCの抗炎症能や内皮バリアー機能の保護といった細胞保護作用はEPCRを必要とし、EPCRに結合したAPCがPAR-1を切断し活性化すると考えられている。トロンビンとAPCはプロテアーゼ活性化受容体-1(protease-activated receptor-1, PAR-1)のArg41およびArg46を各々切断し、切断部位の違いにより異なったシグナルが細胞内に入るとされている。ヒトではAPCはセルピンであるプロテインCインヒビターで阻害される。
3)構造
N末端にγ-carboxy glutamic acid(Gla)ドメイン、続いて2つのEGF(epidermal growth factor)様ドメイン、C末端にセリンプロテアーゼドメインをもつ。Glaドメインが欠如したAPCの立体構造が決定されている。ヒトPCのN末端領域のGlaドメイン内の9つのGlu残基は、小胞体のγ-グルタミルカルボキシラーゼによりビタミンK依存性にカルボキシル基が付加されてGla残基に変換されている。これらのGla残基にCa2+が結合するとGlaドメインの立体構造が変化し、ドメイン内の複数の疎水性アミノ酸残基が露出する。PCはGlaドメインを介してEPCRに結合する。PCのGlaドメインとEPCRの細胞外領域の複合体の立体構造が報告された[1]。また、APC-FVa複合体の立体構造がクライオ電子顕微鏡を用いて決定された[2]。APCはプロテアーゼドメインだけでFVaのA2ドメインに結合しており、GlaドメインとEGF様ドメインは足場としての役割を果たしていた。
4)病態との関わり
血管内皮細胞上のPC依存性抗凝固反応は極めて重要な抗凝固系であり、PC欠乏症は静脈血栓塞栓症のリスクである。PC欠乏症は一般人口の0.2%程度に見られる。遺伝的なPC欠乏症は若年発症の深部静脈血栓症や肺血栓塞栓症などの静脈血栓塞栓症を発症しやすい。また動脈血栓症の発症も観察される。極めてまれな先天性ホモ接合体もしくは複合ヘテロ接合体によるPC欠乏症は、新生児期に紫斑や出血性壊死、さらには多発性微小血栓による多臓器不全をきたす電撃性紫斑病を発症する場合がある。
図表
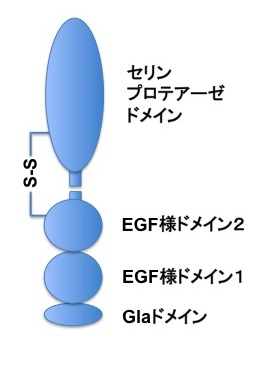
プロテインCの模式図
引用文献
- Oganesyan V, Oganesyan N, Terzyan S, et al. The crystal structure of the endothelial protein C receptor and a bound phospholipid. J Biol Chem. 2002; 277:24851-4
- Mohammed BM, Basore K, Di Cera E. Cryo-EM structure of coagulation factor Va bound to activated protein C. Blood. 2025; 145:3166-77
参考文献
Dahlback B. Advances in Understanding Mechanisms of Thrombophilic Disorders. Hamostaseologie. 2020; 40:12-21
