- 大分類
-
- 凝固
- 小分類
-
- 機構
セリンプロテアーゼ serine protease
解説
セリンプロテアーゼとは、活性中心にセリン残基をもつプロテアーゼ(タンパク質分解酵素)のことであり、多くは触媒残基としてセリン、ヒスチジン、アスパラギン酸の3残基を有している。セリンプロテアーゼによる基質タンパク質の分解は、活性中心のセリン残基中の酸素原子によるペプチド結合を構成するカルボニル炭素への求核攻撃を起点として、最終的にペプチド結合を切断する。
凝固第VIII(a)因子や凝固第V(a)因子のような凝固補酵素タンパク質、トロンビンによるプロテインC活性化のコファクターとして機能するトロンボモジュリンや血管内皮細胞プロテインC受容体(EPCR)、活性化プロテインCによる活性型凝固補酵素タンパク質第VIIIa因子/第Va因子分解のコファクターとして機能するプロテインSなどを除くと、いずれもセリンプロテアーゼ前駆体の、活性型セリンプロテアーゼによる逐次的な活性化反応からなり、カスケード反応とも呼ばれる。
活性型セリンプロテアーゼによる前駆体型セリンプロテアーゼの活性化は、そのほとんどが一本鎖タンパク質が限定分解を受けて2本鎖に変換される過程であり、これにより生成した高分子量鎖(heavy chain)と低分子量鎖(light chain)がセリンプロテアーゼ活性を示すために重要な立体構造を形成する。
セリンプロテアーゼは、セリンプロテアーゼインヒビター(セルピン)により阻害されるが、その際、セルピンはセリンプロテアーゼに対して反応部位と呼ばれる部分を差出し、それがセリンプロテアーゼにより切断されると、セリンプロテアーゼの活性中心であるセリン残基とセルピン上のP1残基(反応部位のN末端側アミノ酸)との間でアシル結合が形成され、セリンプロテアーゼは失活するが、同時にセルピンの活性も失われる。
このことからセルピンは自殺基質とも呼ばれ、従って、それぞれのセルピンのセリンプロテアーゼに対する阻害特異性は、セルピン上のP1残基(反応部位のN末端側に位置するアミノ酸)とP1‘残基(反応部位のC末端側アミノ酸)周辺の配列により影響される。
一般的に、凝固系に関わるセリンプロテアーゼ前駆体の欠損症は、出血傾向を示し、その代表的なものには血液凝固第IX因子の欠乏に起因する血友病Bがある。一方、凝固制御系および線溶系に関わるセリンプロテアーゼの欠損症は一般的に血栓傾向を示し、代表例として、プロテインC欠乏症やプラスミノゲン欠乏症がある。
図表
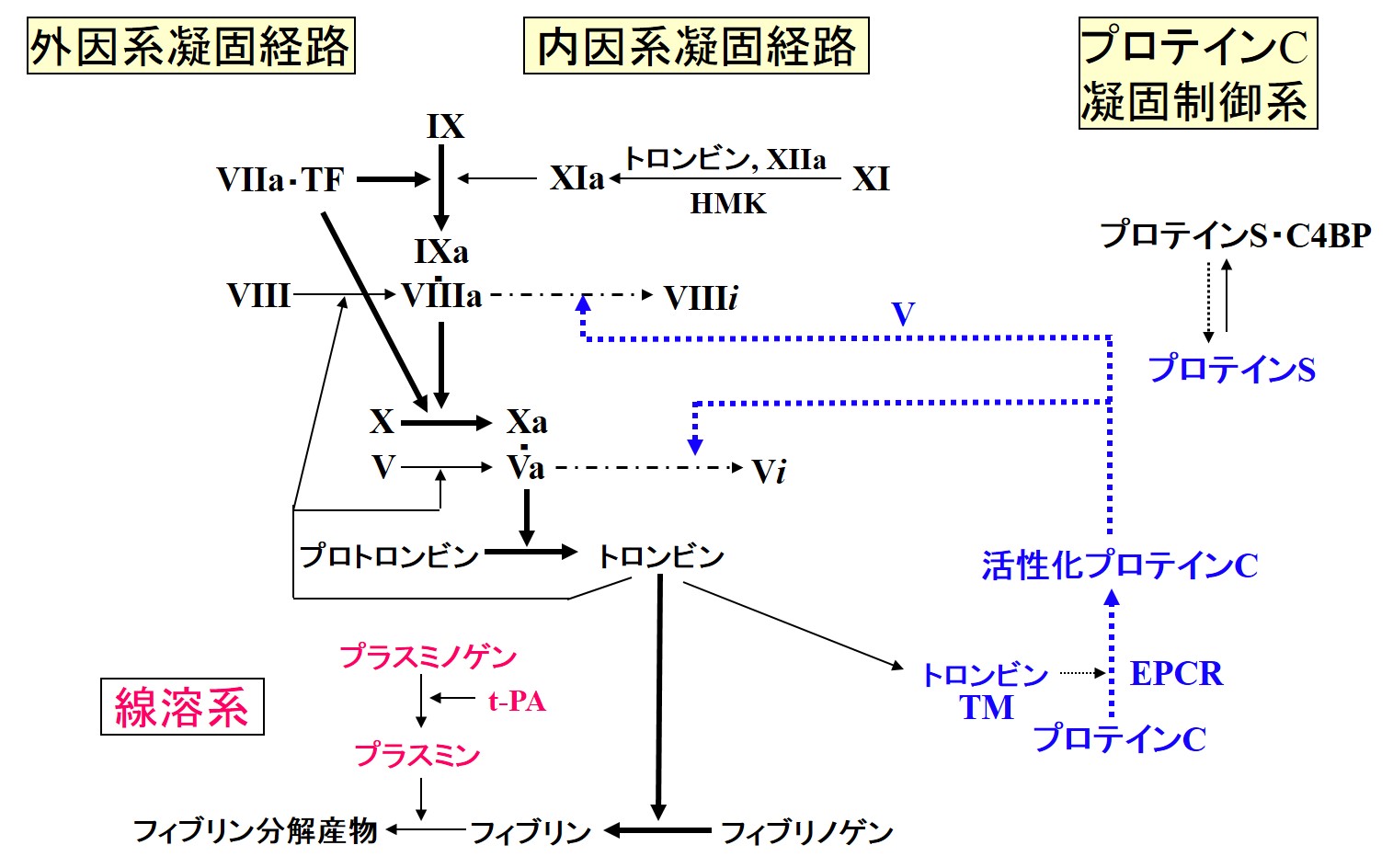
血液凝固系、凝固制御系及び線溶系の概略図
HMK: 高分子キニノゲン, TM: トロンボモジュリン, EPCR: 内皮細胞プロテインC受容体, t-PA: 組織プラスノゲンアクチベータ
参考文献
1. 林 辰弥、鈴木 宏治. 血漿凝固・線溶制御セルピンの構造と機能.
日本血栓止血学会誌、23:481-493、2012.
