- 大分類
-
- 線溶
- 小分類
-
- 病態
悪性腫瘍と線溶 Malignant tumors and fibrinolytic system
解説
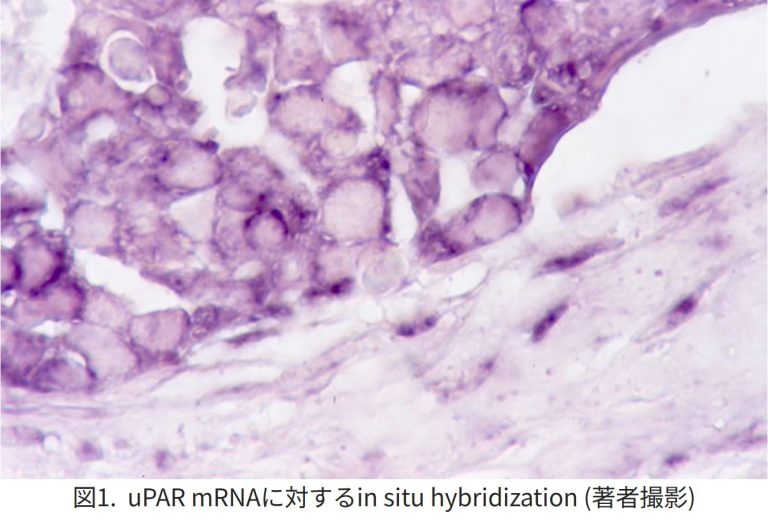
悪性腫瘍においてはセリンプロテアーゼのひとつであるウロキナーゼ型プラスミノゲンアクチベータ(uPA)や組織型プラスミノゲンアクチベータ(tPA)が発現し、uPAはプラスミノゲンを加水分解しプラスミンへと活性化させ、さらにはpro-collagenaseを活性化することによって、細胞外マトリックスを融解することにより悪性腫瘍の浸潤・転移に関与すると考えられている1).また、腫瘍間質部の線維芽細胞は、プラスミノゲンアクチベータインヒビター1(PAI-1)やPAI-2を分泌し、効率よくuPAと結合してその活性を阻害するものと考えられている2)3).PAI-1、PAI-2、uPAおよびuPA受容体(uPAR)は腫瘍浸潤部に多く局在し(図1)、腫瘍と間質の相互作用が示唆された4).uPAの強発現は予後不良因子と考えられる. uPARはVEGF(Vascular endothelial growth factor)を誘導して血管新生に関与し5,6)、インテグリンに影響して癌細胞の接着にも関係する7).PAI-1はuPA/uPARと細胞外マトリックスタンパク質との結合を修飾し、浸潤・増殖を促進する可能性も示されている。上皮間葉転換(epithelial-mesenchymal transition; EMT)においても、uPA/uPARは、Ras遺伝子を活性化する遺伝子を抑制することにより、EMTや幹細胞様の性質をもつ細胞を誘導するという報告がある8).急性前骨髄性白血病(APL)や一部の固形癌では血管内皮やマクロファージや腫瘍細胞の膜表面にアネキシンA2が存在し、tPAおよびプラスミンと結合してプラスミノゲンを活性化することによって、播種性血管内凝固症候群(DIC)を引き起こすといわれている9).
■乳癌の予後因子としてのuPA /PAI
American Society of Clinical Oncology(ASCO)の前向きランダム化試験におけるChemo-N0 trial(1993-1998、n=647)の10年最終解析10)が2013年に報告され、乳がんにおいて腫瘍組織中のuPA/PAI-1抗原量は独立した予後規定因子とされた. ASCOやESMO(European Society for Medical Oncology)などヨーロッパの主要学会では、リンパ節転移陰性の乳がん患者に限り、予後予測因子として酵素免疫測定法(ELISA)による測定を弱く推奨している11) 12).しかし、National Comprehensive Cancer Network(NCCN)ガイドラインにおいては記載されておらず、乳がん以外のがんに関してはuPA/uPARの発現と予後因子についての研究はされているが、臨床応用は進んでいない13).
■uPARをターゲットとした画像診断
uPARは正常組織における発現は少ないので、そのD3領域に親和性を持つアミノ酸(AE105)に標識された68Ga-NOTA-AE105を用いてPET検査を行い、予後や進行度を評価する臨床試験が多数行われている13). 前立腺がん(NCT03307460、PET/MRI侵攻性評価、グレード予測)14)、頭頸部扁平上皮がん(NCT02965001、PET/CT予後予測)15)、多発性転移性去勢抵抗性前立腺がん(NCT02964988、PET/CT骨転移)16)などがフェーズIIで進行中である. 神経膠芽腫におけるフェーズII試験(NCT02945826)ではPET/MRIの結果と生存期間の相関解析結果が報告された17).
■癌治療への応用
Curasight社(デンマーク)はuPARを発現するがん種(悪性脳腫瘍(神経膠芽腫を含む)、神経内分泌腫瘍(NET)、頭頸部扁平上皮がん(HNSCC)、非小細胞肺がん(NSCLC)膵臓がん)を対象に、uPARを画像(PET)で認識して(uTRACER)放射線治療(uTREATR)を行う臨床試験(バスケット型フェーズ I/IIa(コホート研究))を2025年初頭に開始すると報告している18).
uPAの活性阻害薬(WX-671)19) 20)やuPAのメチル化を促進するS-adenosylmethionine(SAM) 21)、抗uPAR抗体(huATN-658)22)などは基礎研究では効果を確認できるも、臨床研究で有効性を示すところまでは至っていない13).がん細胞においてuPA/uPAR遺伝子の発現を低下させるとepidermal growth factor receptor (EGFR)を介したMEC-ERK経路が抑制され、血管新生が減弱し、アポトーシスが進むことが報告されており13)、神経膠腫に対するuPAR遺伝子のantisense oligonucleotides(aODNs)導入ウイルスベクターを用いた腫瘍の増殖抑制の研究23)も進んでいる24) 25). 2025年2月にはPAI-1阻害薬(TM5614)を用いた悪性黒色腫に対する第III相医師主導治験も始まった26). 今後より多くのがん種に対する臨床応用が期待される.
図表
引用文献
- Mignatti P, Rifkin DB: Biology and biochemistry of proteinases on tumor invasion. Physiol Rev73: 161-195, 1993.
- Grøndahl-Hansen J, Christensen IJ, Rosenquist C, Brünner N, Mouridsen HT, Danø K, Blichert-Toft M: High levels of urokinase-type plasminogen activator and its inhibitor PAI-1 in cytosolic extracts of breast carcinomas are associated with poor prognosis. Cancer Res53: 2513-2521, 1993.
- Danø K, Behrendt N, Brunner B, Ellis V, Ploug M, Pyke, 高橋敬, 坂田洋一訳: The urokinase receptor. Protein structure and role in plasminogen activator and cancer invasion. 血栓止血誌6:212-236,1995.
- Umeda T, Eguchi Y, Okino K, Kodama M, Hattori T: Cellular localization of urokinase-type plasminogen activator, its inhibitors, and their mRNAs in breast cancer tissues. J Pathol183: 388-397, 1997.
- Uhrin P, Breuss JM: uPAR: a modulator of VEGF-induced angiogenesis. Cell Adh Migr7: 23-26, 2013.
- Rao JS, Gujrati M, Chetty C: Tumor-associated soluble uPAR-directed endothelial cell motility and tumor angiogenesis. Oncogenesis2: e53, 2013.
- Noh H, Hong S, Huang S: Role of urokinase receptor in tumor progression and development. Theranostics3: 487-495, 2013.
- Jo M, Eastman BM, Webb DL, Stoletov K, Klemke R, Gonias SL: Cell signaling by urokinase-type plasminogen activator receptor induces stem cell-like properties in breast cancer cells. Cancer Res70: 8948-8958, 2010.
- Menell JS, Cesarman GM, Jacovina AT, McLaughlin MA, Lev EA, Hajjar KA: Annexin II and bleeding in acute promyelocytic leukemia. N Engl J Med340: 994-1004, 1999.
- Harbeck N, Schmitt M, Meisner C, Friedel C, Untch M, Schmidt M, Sweep CG, Lisboa BW, Lux MP, Beck T, Hasmüller S, Kiechle M, Jänicke F, Thomssen C; Chemo-N 0 Study Group: Ten-year analysis of the prospective multicentre Chemo-N0 trial validates American Society of Clinical Oncology (ASCO)-recommended biomarkers uPA and PAI-1 for therapy decision making in node-negative breast cancer patients. Eur J Cancer49: 1825-1835, 2013.
- Jacobs VR, Kates RE, Kantelhardt E, Vetter M, Wuerstlein R, Fischer T, Schmitt M, Jaenicke F, Untch M, Thomssen C, Harbeck N: Health economic impact of risk group selection according to ASCO-recommended biomarkers uPA/PAI-1 in node-negative. Breast Cancer Res Treat138: 839-850, 2013.
- Senkus E, Kyriakides S, Penault-Llorca F, Poortmans P, Thompson A, Zackrisson S, Cardoso F: Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol24: vi7-vi23. 10.1093/annonc/mdt284, 2013.
- 窓岩精治 がんと線溶(臨床) 血栓止血学会誌33:321-328, 2022.
- Fosbøl MØ, Kurbegovic S, Johannesen HH, Røder MA, Hansen AE, Mortensen J, Loft A, PetersenPM, Madsen J, Brasso K, Kjaer A: Urokinase-Type Plasminogen Activator Receptor (uPAR) PET/MRI of Prostate Cancer for Noninvasive Evaluation of Aggressiveness: Comparison with Gleason Score in a Prospective Phase 2 Clinical Trial. J Nucl Med62: 354-359. DOI: https://doi.org/10.2967/jnumed.120.248120, 2021.
- Risør LM, Clausen MM, Ujmajuridze Z, Farhadi M, Andersen KF, Loft A, Friborg J,Kjaer A: Prognostic Value of Urokinase-Type Plasminogen Activator Receptor PET/CT in Head and Neck Squamous Cell Carcinomas and Comparison with 18F-FDG PET/CT: A Single-Center Prospective Study. J Nucl Med63:1169-1176,2022. DOI: https://doi.org/10.2967/jnumed.121.262866,2021.
- Fosbøl MØ, Mortensen J, Petersen PM, Loft A, Madsen J, Kjaer A: uPAR PET/CT for Prognostication and Response Assessment in Patients with Metastatic Castration-Resistant Prostate Cancer Undergoing Radium-223 Therapy. A Prospective Phase II Study. Diagnostics11: 1087, 2021. https://doi.org/10.3390/diagnostics11061087, 2021.
- Azam A, Kurbegovic S, Carlsen EA, Andersen TL, Larsen VA, Law I, Skjøth-Rasmussen J,Kjaer A: Prospective phase II trial of [68Ga] Ga-NOTA-AE105 uPAR-PET/MRI in patients with primary gliomas: Prognostic value and Implications for uPAR-targeted Radionuclide Therapy. EJNMMI Res14:100. doi: 10.1186/s13550-024-01164-9, 2024.
- Curasight社HP
- Meyer JE, Brocks C, Graefe H, Mala C, Thäns N, Bürgle M, Rempel A, Rotter N, Wollenberg B, Lang S: The Oral Serine Protease Inhibitor WX-671 – First Experience in Patients with Advanced Head and Neck Carcinoma. Breast Care (Basel) 3:20-24. doi: 10.1159/000151736,2008.
- Heinemann V, Ebert MP, Laubender RP, Bevan P, Mala C, Boeck S: Phase II randomised proof-of-concept study of the urokinase inhibitor upamostat (WX-671) in combination with gemcitabine compared with gemcitabine alone in patients with non-resectable, locally advanced pancreatic cancer. Br J Cancer108:766-770, 2013. doi: 10.1038/bjc.2013.62, 2013.
- Mahmood N, Cheishvili D, Arakelian A, Tanvir I, Khan HA, Pépin AS, Szyf M, Rabbani SA: Methyl donor S-adenosylmethionine (SAM) supplementation attenuates breast cancer growth, invasion, and metastasisin vivo; therapeutic and chemopreventive applications: Oncotarget9:5169-5183, 2017. doi: 10.18632/oncotarget.23704. eCollection 2018 Jan 12.
- Mahmood N, Arakelian A, Khan HA, Tanvir I, Mazar AP, Rabbani SA. uPAR antibody (huATN-658) and Zometa reduce breast cancer growth and skeletal lesions. Bone Res8:18, 2020. doi: 10.1038/s41413-020-0094-3. eCollection 2020.
-
Mohan PM, Chintala SK, Mohanam S, Gladson CL, Kim ES, Gokaslan ZL, Lakka SS, Roth JA, Fang B, Sawaya R, Kyritsis AP, RaoJS:Adenovirus-mediated delivery of antisense gene to urokinase-type plasminogen activator receptor suppresses glioma invasion and tumor growth. Cancer Res 59:3369-3373,1999.
- Gondi CS, Lakka SS, Yanamandra N, Siddique K, Dinh DH, Olivero WC, Gujrati M, Rao JS: Retraction Note: Expression of antisense uPAR and antisense uPA from a bicistronic adenoviral construct inhibits glioma cell invasion, tumor growth, and angiogenesis. Oncogene44:1435, 2025. doi: 10.1038/s41388-025-03401-4.
-
Gondi CS, Lakka SS, Yanamandra N, Siddique K, Dinh DH, Olivero WC, Gujrati M, Rao JS: Retraction Note: Expression of antisense uPAR and antisense uPA from a bicistronic adenoviral construct inhibits glioma cell invasion, tumor growth, and angiogenesis. Oncogene44:1435, 2025. doi: 10.1038/s41388-025-03401-4.
-
東北大学病院.悪性黒色腫(メラノーマ)の第III相医師主導治験の開始について[Internet].仙台:東北大学;2025[cited 2025 Feb19].Available from:https://www.hosp.tohoku.ac.jp/release/news/43570.html