- 大分類
-
- 凝固
- 小分類
-
- 分子
TFPI(tissue factor pathway inhibitor) tissue factor pathway inhibitor
解説
■概要
TFPI(Tissue Factor Pathway Inhibitor)は1987年にBrozeらにより報告されたセリンプロテアーゼインヒビターである。TFPIには3種類のスプライシング異性体(TFPIα、TFPIβ、TFPIδ)が存在するが、TFPIδの生理的意義は不明であるTFPIは活性化凝固第Ⅹ因子(FⅩa)並びに組織因子・活性化凝固第Ⅶ因子(TF・FVIIa)複合体と結合して、外因系凝固反応を抑制する。
■分子量、産生部位、血中濃度
TFPIαの分子量は糖鎖の結合状態により異なり32-43kDである。TFPIの産生場所は血管内皮細胞(特に毛細血管)の他、巨核球、血小板などでも産生される。
存在部位としては血管内皮細胞が主であるが、TFPIαは血液中にも存在し、ヒト血漿中の総TFPI濃度は50~90 ng/mL(1.5~2.5nM程度)で、約80%がリポタンパク質(LDL;HDL;VLDL)結合型である。残りの20%程度が遊離型で、その約半分はC末端領域が欠損している。また、血小板の活性化に伴って血小板内のTFPIαが膜表面に発現することも明らかにされている。
■構造と機能
TFPIαは276個のアミノ酸からなり、酸性アミノ酸に富むN末端領域、3個の縦列のKunitz型ドメイン(K1,K2,K3)、塩基性アミノ酸に富むC末端領域が存在する。TFPIβはK3以降のC末端領域を欠き、193番目のアミノ酸に続くglycosyl phosphatidyl inositol (GPI) アンカーを介して血管内皮細胞表面に結合している。抗凝固作用の発揮においてはK1のTF・FVIIa複合体への結合はK2がFXaと結合することにより、より効果的となる。TFPIαのFXa阻害活性はTFPIβの20倍と報告されており、これにはプロテインSがTFPIのK3ドメインを介してTFPIとFⅩaとの結合を促進させ、活性化プロテインC非依存的にTFPIのFⅩa阻害活性を顕著に高めること、また、TFPIαのC末領域が活性化第V因子(FⅤa)のBドメインと結合してプロトロンビナーゼ(FⅩa-FⅤa-リン脂質複合体)の働きを抑制することなどが関与していると考えられる。
血中のTFPIαの凝固阻害活性は細胞膜結合TFPIと比較して弱く、リポタンパク質結合型TFPIの抗凝固活性は特に弱い。
■ノック・アウトマウスの表現型
TFPIノックアウト(K1ドメインホモ欠失)マウスでは、胎齢11.5日までに約半数が死亡し、出生時までにほぼ死滅した。原因は出血性イベントと考えられる。その後、FVIIもノックアウトしたダブルノックアウトマウスが作製され、抗凝固因子であるTFPIに加え、凝固因子であるFVIIもノックアウトすることにより、生命がレスキューされることが判明した。そのため、TFPI ノックアウトによる死因は血管形成不全ではなく、凝固障害によると考えられている。
■病態との関わり
先天性TFPI欠乏症の報告はない。
播種性血管内凝固(DIC)では血中の総TFPIが増加し、遊離TFPI(完全長TFPI)は減少していることが報告されている。
■その他のポイント
ヘパリンの投与により血管内皮細胞のグリコサミノグリカンに結合したTFPI(主にC末端を保持しているTFPIα)が遊離して血中濃度が1.5~3倍に上昇する。近年になって、GPIを特異的に切断するphosphatidyl inositol-specific phospholipase C (PIPLC)の処理によりヘパリン処理の10倍以上も血中TFPI濃度が高まることが報告され、血管内皮細胞表面にTFPIβが多量に結合していると考えられるようになった。
■お役立ち情報
2023年血友病治療において抗TFPI抗体薬が実用化された。主な薬効として2次的にトロンビン生成能が回復することが示されている。
図表
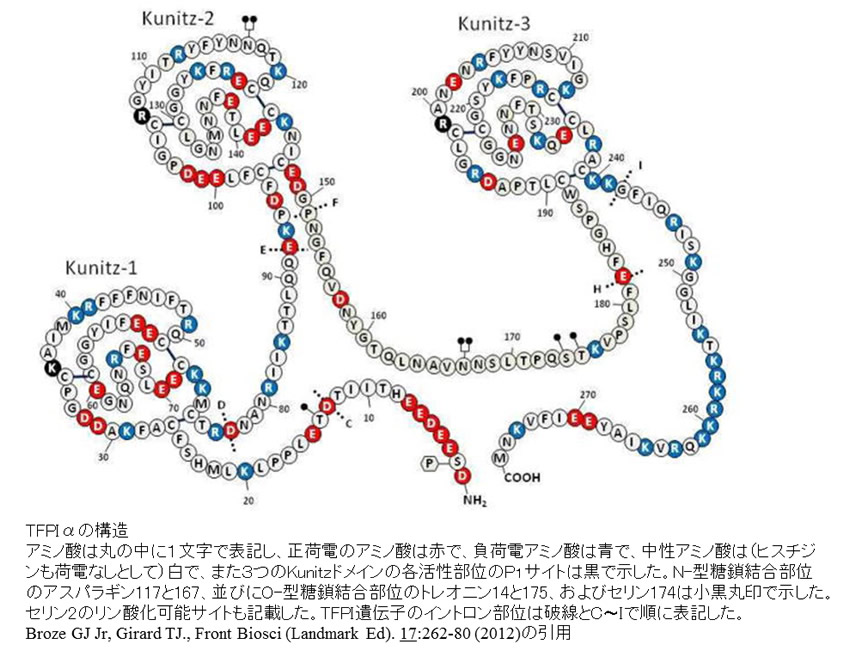
TFPIαの構造(Broze GJ Jr, Girard TJ.より引用)
参考文献
- Crawley JT, Lane DA. The haemostatic role of tissue factor pathway inhibitor. Arterioscler Thromb Vasc Biol 2008;28:233-242.
- 血栓止血誌2014; 25(1): 5-10
- 血栓止血誌2014; 25(1): 11-22
- 血栓止血誌2022; 33(1): 23-30
