- 大分類
-
- 凝固
- 小分類
-
- 分子
アンチトロンビン antithrombin
解説
【概要】
アンチトロンビン(Antithrombin: AT)は、肝臓で合成される分子量58,000の1本鎖糖タンパク質である。活性化凝固因子であるトロンビン、Xa、IXa、XIa、XIIaおよびVIIa-組織因子複合体などのセリンプロテアーゼに対して1:1で複合体を形成して凝固因子活性を阻害する。血栓制御に重要な抗凝固因子の一つである。
【構造と機能】
血中のATは432のアミノ酸残基で構成される。ATによるセリンプロテアーゼ阻害作用は、ATのC末端近くの反応部位であるArg393-Ser394結合がプロテアーゼによって切断され、Arg393とプロテアーゼの活性中心残基(Ser)との間に共有結合が形成されることにより発揮される。ATにヘパリンが結合すると、トロンビン阻害活性は約1,000倍、Xa阻害活性は約300倍にまで増強される。
ATはヘパリンに結合すると立体構造が変化しプロテアーゼ阻害活性が増強される。加えて、トロンビン阻害の場合、ヘパリンにATとトロンビンの両方が結合し、AT・ヘパリン・トロンビンの三者複合体を形成する(図1-a)。この2つのヘパリンの作用により、ATによるトロンビン阻害は大きく増強する(約1,000倍)。低分子ヘパリンやフォンダパリヌクスでは、ヘパリンの長さが短いので三者複合体を形成することができず、ATのトロンビン阻害活性を増強する作用が弱い(図1-b)。Xa阻害の場合、ヘパリンに結合したATはXa阻害活性が増強されるものの、ヘパリンとXaは結合しないので三者複合体を形成することができず、ヘパリンによるATのXa阻害の増強度はトロンビン阻害より低い(約300倍)。
生体内では血管内皮細胞上にヘパラン硫酸が存在し、ヘパリン様の抗凝固作用を発揮している。
【遺伝子】
AT遺伝子(SERPINC1)は、染色体1q23-25上に13.4 kbの長さで存在し、7つのエクソンと6つのイントロンより構成される。機能単位であるヘパリン結合領域はエクソン2および3、反応部位はエクソン7にコードされている。
【臨床的意義】
ATは低値の場合に静脈血栓塞栓症(VTE)など血栓症のリスク因子となり、臨床的に重要視される。
<AT低値の先天的要因>
先天性AT欠乏症:常染色体顕性遺伝形式をとり、ATの抗原量と活性が共に低下するI型欠乏症(産生異常)と、ATの抗原量は正常であるが活性が低下するII型欠乏症(分子異常)に分類される(II型はさらに3つのサブタイプに分類される)。日本人の一般住民を対象とした研究では先天性AT欠乏症の頻度は0.15%と推定されており、VTE発症リスクは一般住民の約38倍と非常に高い1)。特にI型欠乏症はII型欠乏症と比してVTE発症リスクが約7倍高く、若年でVTEを発症しやすい2)。
<AT低値の後天的要因>
・ATの産生低下:肝機能障害(肝硬変、劇症肝炎、肝不全)、L-アスパラギナーゼ投与
・ATの消費亢進:大手術、急性血栓症、播種性血管内凝固症候群(DIC)、重症敗血症(好中球エラスターゼによる分解)、悪性腫瘍、長期の体外循環、広範囲の熱傷
・ATのクリアランス亢進:ヘパリンの投与、ネフローゼ症候群、妊娠高血圧症候群
・その他:エストロゲン製剤
【検査法】
ATの検査法として、抗原量測定と活性測定がある。測定原理と基準値3)を以下に示す。
AT抗原量:ラテックス免疫比濁法(基準値:23.6 ~ 33.5 mg/dL)
AT活性:合成基質法(基準値:80 ~ 130%)
日常の臨床検査ではAT活性が測定されており、AT抗原量は外部委託している施設が大半を占める。AT活性(合成基質法)は、被検血漿にヘパリンと一定過剰量のXaを添加して、ATのXa阻害活性を発色合成基質を用いて測定する方法である(図2)。このようにXaを用いる方法を「Xa阻害法」、Xaの代わりにトロンビンを用いる方法を「トロンビン阻害法」という。日本ではXa阻害法を用いた試薬を採用している施設が多い。
直接経口抗凝固薬(DOAC)による測定法の使い分け:AT活性測定においてトロンビン阻害法とXa阻害法の違いが重要になるのは、DOACを服用する患者である。DOACには「Xa阻害薬」であるリバーロキサバン、アピキサバン、エドキサバンと、「トロンビン阻害薬」であるダビガトランがある。リバーロキサバン、アピキサバン、エドキサバンの服用患者にXa阻害法を用いたAT試薬を用いるとAT活性が偽高値になることがある。同様にダビガトラン服用患者ではトロンビン阻害法を用いたAT試薬を用いるとAT活性は偽高値になることがある4)。DOAC服用患者でAT活性を測定する際はどの測定法を使用するかに注意し、自施設で使用するAT試薬がどちらの測定法であるかを把握しておくことが重要である。DOACの血中濃度が低下した血漿では偽高値を示すことが低くなるので、偽高値を避けるためDOAC服薬の直前に採血することが薦められる。
図表

図1 ヘパリンによるATのプロテアーゼ阻害活性の増強 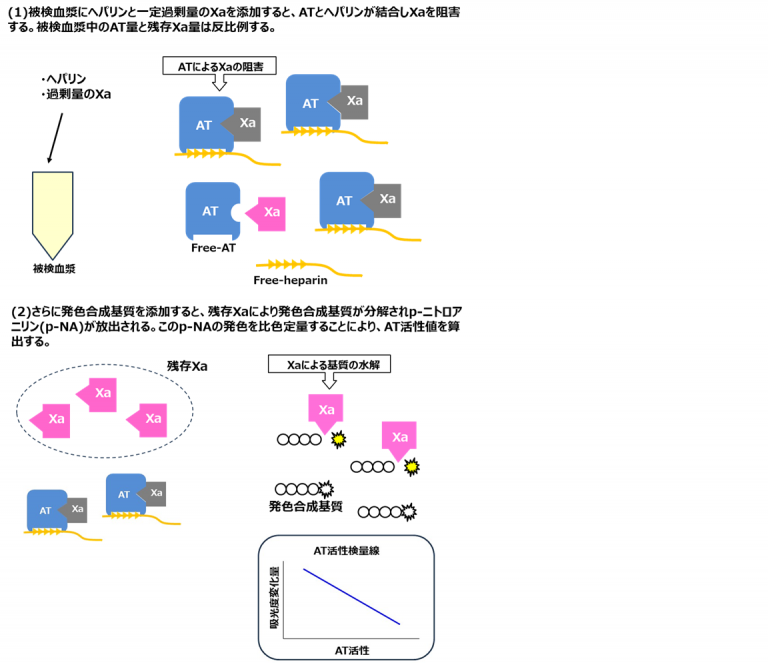
図2 AT活性測定原理
引用文献
1) Sakata T, et al. Protein C and antithrombin deficiency are important risk factors for deep vein thrombosis in Japanese. J Thromb Haemost. 2004; 2: 528-530.
2) Mitsuguro M, et al. Usefulness of antithrombin deficiency phenotypes for risk assessment of venous thromboembolism: type I deficiency as a strong risk factor for venous thromboembolism. Int J Hematol. 2010; 92: 468-473.
3) 小嶋哲人. 凝固検査. 監修 金井正光. 臨床検査法提要 改訂第35版. 金原出版, 2021, p437-441.
4) 門平靖子, 他. DOAC療法が先天性血栓性素因に及ぼす影響. 血栓止血誌. 2018; 29(1): 20-27.
参考文献
[1] 辻肇. 凝固インヒビター- ATの基礎と臨床. 編集 一瀬白帝, 他. 図説血栓・止血・血管学 血栓症制圧のために. 中外医学社, 2005, 483-489.
[2] 森下英理子. アンチトロンビン, プロテインC, プロテインS. 編著 朝倉英策. 臨床に直結する血栓止血学 改訂 第3版. 中外医学社, 2024; 74-78.
[3] 森下英理子. 先天性アンチトロンビン(AT)・プロテインC(PC)・プロテインS(PS)欠乏症. 編著 朝倉英策. 臨床に直結する血栓止血学 改訂 第3版. 中外医学社, 2024; 424-429.
[4] Hoffman R, et al. Elsevier Saunders. Hematology, Basic Principles and Practice, 6 th Ed. 2013; 2014-2015.
[5] 田村彰吾, 他. 先天性アンチトロンビン欠乏症. 血栓止血誌. 2024; 35(5): 612-618.
[6] 城谷裕子, 他. アンチトロンビンのプロテアーゼ阻害機構とヘパリンの作用 -立体構造で見る動的構造変化-. 血栓止血誌. 1999; 10(1): 93-99.
