- 大分類
-
- 凝固
- 小分類
-
- 分子
凝固第V因子(FV) coagulation factor V
解説
【概要】
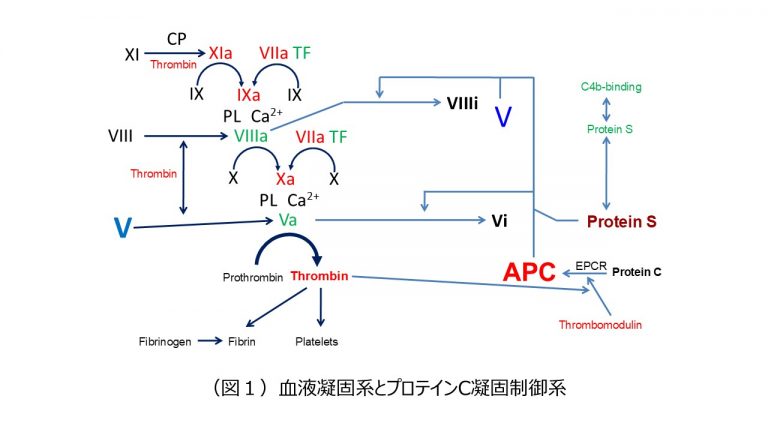
凝固第V因子(Coagulation factor V : FV)は、血液凝固カスケードのコファクターとして働く凝固因子の1つである1)。通常、血液中では、活性がない非活性型のFVとして循環しており、トロンビンや活性型第X因子(FXa)などのセリンプロテアーゼによって活性化を受け活性型FV(FVa)になる。FVaは、血小板膜上でプロトロンビナーゼ複合体(FXa+FVa+リン脂質+Ca2+)を形成して、プロトロンビンをトロンビンへと活性化し、凝固反応を促進する。FVaは活性化プロテインC(Activated protein C : APC)により限定分解を受けて不活化される(FVai)。
【分子量・半減期・血中濃度】
FVは、分子量約330 KDaの一本鎖糖タンパク質として主に肝臓で合成され、濃度約7 µg/mL(20 nM)で血中に存在する。半減期は、約15~36時間である。血小板α顆粒、巨核球、単球、内皮細胞などにも存在し、巨核球でも合成されると考えられている。
【構造と機能】
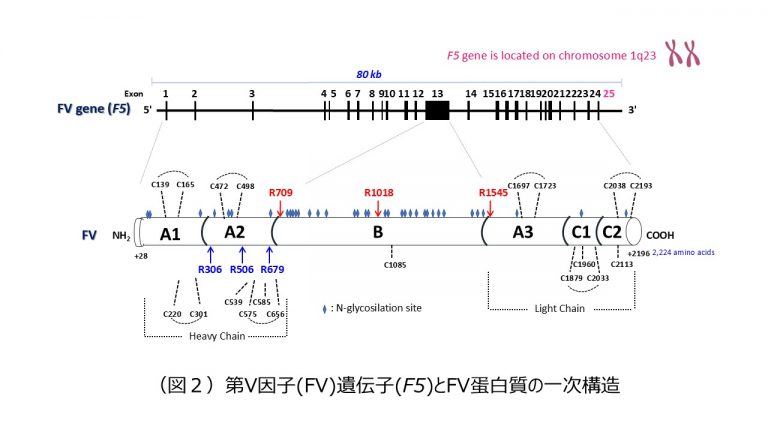
FV遺伝子(F5)は染色体1q23に位置し、大きさは約80 Kbで、25のエクソンが、28アミノ酸のシグナルペプチドを含む2,224アミノ酸から構成されるFVタンパク質をコードしている2)。
FV前駆体タンパク質は、肝臓で合成され、一次翻訳産物は一連の翻訳後修飾を受け、シグナルペプチドが切断されて、最終的に2,196アミノ酸の一本鎖成熟糖タンパク質として血中に分泌される2)。
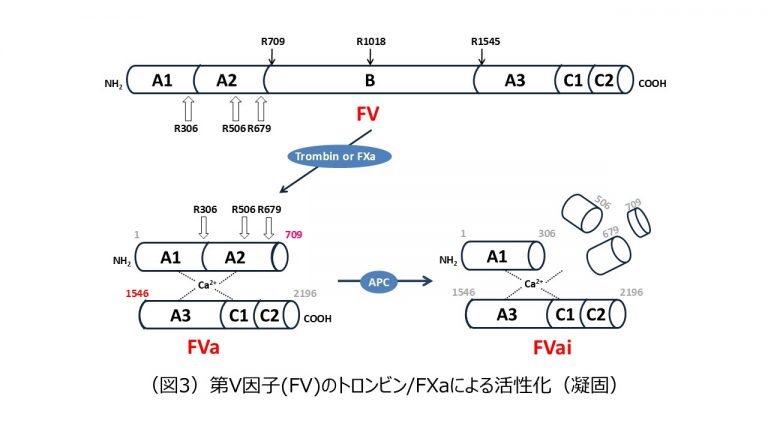
FVは、凝固第VIII因子(FVIII)やセルロプラスミンなどの銅結合性タンパク質とA1-A2-B-A3-C1-C2の共通ドメイン構造をとる。トロンビンやFXaによるFVの活性化は、Arg709、Arg1018、Arg1545のペプチド結合が切断され3)、Bドメインが解離すると、A1-A2ドメイン(Heavy chain)とCa2+を介して非共有結合したA3-C1-C2ドメイン(Light chain)が結合したFVaになる。C2ドメインは、FVaとリン脂質膜との相互作用に不可欠である。また、A3ドメインにも膜結合領域が存在している可能性もある。
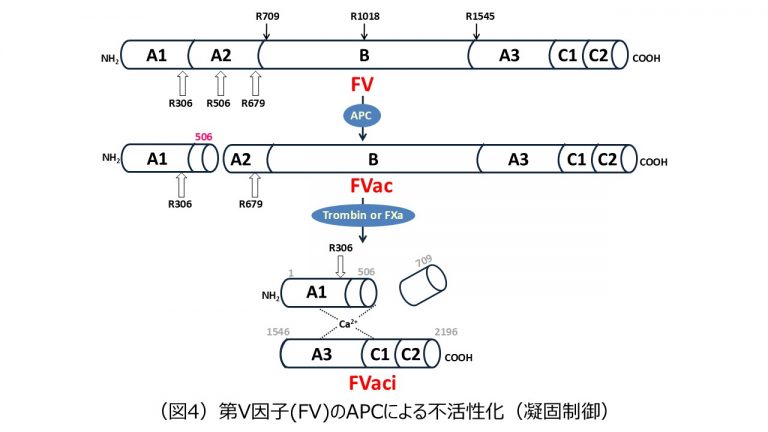
FV/FVaは、APCによって、そのコファクターであるプロテインS(Protein S:PS)の存在下で(APC+PS+リン脂質+Ca2+)、Arg306、Arg506、Arg679が開裂し(APCプロテオリシス)、不活性化される4)。また、APCが活性型FVIII(FVIIIa)を不活性化する際に、FVはPSと結合することによって、APCのコファクターとして抗凝固作用を発揮する。
【ノックアウトマウスの表現型】
FVノックアウトマウス(FV-/-)は致死性であることから、FVは生命維持に不可欠な血液凝固因子であると考えられる。ヒトにおいては、血液中FV活性1%未満の重症型FV欠乏症の場合においても致死的ではなく、その出血症状も重篤な症例から軽微な出血症状の症例、無症候性など、さまざまである。
【病態との関わり】
先天性FV欠乏症・異常症は、F5遺伝子の遺伝子変異・遺伝子バリアントを病因とするFVの量的欠乏または分子機能異常による出血性疾患である。
一方、Factor V Leiden(ファクターファイブライデン:FV Leiden)は、F5の遺伝子バリアント(FV R506Q変異)であり、世界で最も知られている遺伝性静脈血栓症の危険因子である。FV Leidenは、FVのAPCによる主要な開裂部位であるArg506がGlnに置換され、APCに対する抵抗性(活性化プロテインCレジスタンス:APCR)の主な原因になる。FV R506Q変異は、欧米人には高率で検出されるが、日本人を含む東洋人からは検出されない。
図表
引用文献
1) Jenny RJ, Pittman DD, Toole JJ, Kriz RW, Aldape RA, Hewick RM, Kaufman RJ, Mann KG. Complete cDNA and derived amino acid sequence of human factor V. Proc Natl Acad Sci U S A. 4:4846-50, 1987.
2)Steen M, Dahlback B. Thrombin-mediated proteolysis of factor V resulting in gradual B-domain release and exposure of the factor Xa-binding site. J Biol Chem 277: 38424–30, 2002.
3)Dahlbäck B, Villoutreix BO. The anticoagulant protein C pathway. FEBS Lett. 579: 3310-6, 2005.
4)篠澤圭子:先天性第V因子欠乏症とその遺伝子変異,日本血栓止血学会誌 16:281-296,2005.
5)篠澤圭子,野上恵嗣:Factor V がいよいよ面白くなってきた:血栓症をおこしたFV NARA変異とAPCレジスタンス,日本血栓止血学会誌 25:482-493, 2014.
参考文献
1)Shinozawa K, Amano K, Suzuki T, Tanaka A, Iijima K, Takahashi H, Inaba H, Fukutake K: Molecular characterization of 3 factor V mutations, R2174L, V1813M, and a 5-bp deletion, that cause factor V deficiency. Int J Hematol 86: 407-413, 2007.
2)Nogami K, Shinozawa K, Ogiwara K, Matsumoto T, Amano K, Fukutake K: Novel FV mutation (W1920R, FV Nara) associated with serious deep vein thrombosis and more potent APC resistance relative to FV Leiden. Blood 123: 2420-2428, 2014.