- 大分類
-
- 線溶
- 小分類
-
- 病態
骨髄機能と線溶 Bone marrow function and fibrinolytic system
解説
【線溶系による酵素活性制御】
骨髄は、造血幹細胞から血球への分化を通じた、造血支持組織として機能している。造血幹細胞は「ニッチ」と呼ばれる至適微小環境に存在し、各種生体分子の作用による未分化性の喪失過程を経て、ニッチを離脱、骨髄内の細胞外マトリックス(ECM)中を移動し、血球として、末梢血中へと動員され、全身に供給される。ECMを基質とするmatrix metalloproteinase (MMP)やa disintegrin and metalloproteinase (ADAM)などの近縁遺伝子ファミリーは、こうした細胞群の骨髄内移動、また各種生体分子の細胞外ドメイン分泌(プロセシング)や代謝を制御し、骨髄・造血機能の維持に不可欠な酵素群である。MMPは、まずその前駆体、潜在型酵素ProMMPとして産生され、活性型MMPとして機能する際には、そのプロペプチド部分の酵素的切断による活性化ーProMMPからMMPへの変換が必須のプロセスとなることが明らかとなっている。
こうしたMMPの活性は、各種MMP相互の活性化システムに加え、線溶系を構成するセリンプロテアーゼに分類されるプラスミンによってProMMPからMMPへの変換過程が、制御されていることが、明らかとなった。プラスミンはその前駆体であるプラスミノゲン(Plg)から、ウロキナーゼ型プラスミノゲンアクチベータ(uPA)や組織型プラスミノゲンアクチベータ(tPA)による活性化を経て生成される(図)。
【線溶系による骨髄機能制御】
プラスミノゲン遺伝子欠損マウス(Plg-/-)とその野生型(Plg+/+)を使用した実験では、抗癌剤5-フルオロウラシル(5-FU)による骨髄傷害後の骨髄細胞・組織の再生過程において、Plg-/-は、汎血球減少から回復することなく、二週間以内に全てが死亡し、骨髄組織中でもニッチからの細胞移動が欠如していた。また、骨髄組織の再生過程においてPlg+/+と比較してPlg-/-では、血中の造血因子(stem cell factor; SCF)の濃度上昇とMMP-2、MMP-9の活性化が障害されており、Plg-/-の骨髄細胞は、S期への細胞周期移行も有意に遅延していることが判明した。このことは、プラスミノゲンの欠損が、MMPの活性化とこれに伴う造血因子の分泌障害を通じた、骨髄・造血機能不全の原因となっていることを示唆している1)。
さらに最近の研究でtPA、さらに開発中の薬剤であるPAI-1阻害剤は、骨髄中のプラスミン産生増加、MMPの活性化とSCFの分泌を誘導し、骨髄細胞の分化・増殖、組織再生を促進することが判明した2)。また、tPAによる細胞分化、増殖促進効果はPlg-/-、MMP-9-/-及びSCF遺伝子欠損マウスでは認められなかったことから、線溶系の亢進は、やはりMMPの活性化とサイトカイン、SCF等のプロセシングを介して、これらの上流から骨髄造血を制御しているものと考えられる。これらの研究成果は、線溶系の活性と骨髄・造血機能、そして炎症・免疫系との連関を示唆しており、線溶系因子は、今後の再生医療・創薬の新しい標的分子となる可能性を秘めていると言えよう 3) 。
図表
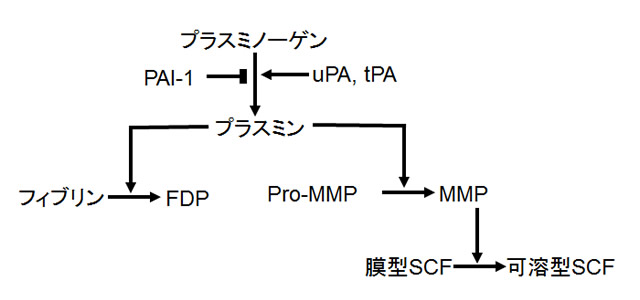
図.線溶系因子を起点としたMMPの活性化機構
潜在型酵素ProMMPから活性型MMPへの変換—MMPの活性化は、プラスミンによって制御されている事が示唆されている。このことは、線溶系の亢進が、MMPの活性化を通じて、SCFをはじめとする多くの生体因子のプロセシングに関与している可能性を示している。
参考文献
1) Heissig B, Lund LR, Akiyama H, Ohki M, Morita Y, Rømer J, Nakauchi H, Okumura K, Ogawa H, Werb Z, Danø K, Hattori K: The plasminogen fibrinolytic pathway is required for hematopoietic regeneration. Cell Stem Cell 1: 658-670, 2007.
2) Tashiro Y, Nishida C, Sato-Kusubata K, Ohki-Koizumi M, Ishihara M, Sato A, Gritli I, Komiyama H, Sato Y, Dan T, Miyata T, Okumura K, Tomiki Y, Sakamoto K, Nakauchi H, Heissig B, Hattori K: Inhibition of PAI-1 induces neutrophil-driven neoangiogenesis and promotes tissue regeneration via production of angiocrine factors in mice. Blood 119: 6382-6393, 2012.
3) Yatsenko T, Rios R, Rios T, Salama Y, Takahashi S, Tabe Y, Naito T, Takahashi T, Hattori K, Heissig B: Urokinase-type plasminogen activator and plasminogen activator inhibitor-1 complex as a serum biomarker for COVID-19. Frontier Immunol 14: 1299792, 2024.
