- 大分類
-
- 血小板
- 小分類
-
- 分子
CLEC-2 C-type lectin-like receptor 2 (CLEC-2)
解説
1)構造など
①概略: C-type lectinファミリーに属する32/40kDa の分子。遺伝子型は CLEC1B。ヒトの血球系では血小板、巨核球に特異的に発現するが、肝類同内皮細胞にも発現するマウスの血球系では、それらに加え、好中球、単球、樹状細胞にも発現する。血球以外では、ヒト、マウスとも Kupffer 細胞と肝類洞内皮細胞に発現するといわれているが、機能は不明である。血小板活性化蛇毒、ロドサイチンの受容体として同定されたが1)、生体内では膜タンパクポドプラニンと結合して血小板を活性化する2)。
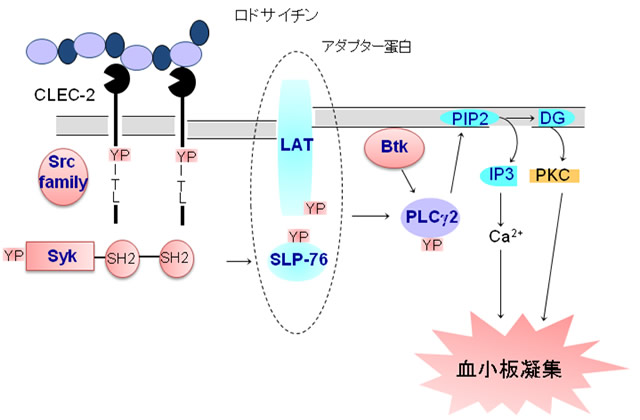
②シグナル伝達: ロドサイチンなどがCLEC-2(C-type lectin-like receptor 2)に結合すると、Src family kinase等がCLEC-2 細胞内ドメインのひとつの YITLモチーフ(hemi-ITAMという)のチロシン残基をリン酸化(YP) し、そこにチロシンキナーゼSyk がその2つの SH2 ドメインで結合して、活性化される。Syk はその後、LATやSLP-76 といったアダプタータンパクをチロシンリン酸化し、最終的にはPLCγ2 の活性化、血小板凝集が惹起される1,3)。
③リガンド他: 生体内リガンド(ポドプラニン2)、S100A1312)、hemin/heme13, 14)、Dectin-121)) 生体外リガンド(rhodocytin1)、fucoidan15)、diesel particle16)、カラギーナン17)) 阻害剤(2-CP18), cobalt hematoporphyrin19), diphenyl-tetrazol-propanamide 誘導体20))
2)機能
生理的役割
1.発生における役割
① 胎生期と出生後ともにリンパ管と血管の分離を促進する5,7)。
② 肺発生を促進する26)
2.血栓止血
① 血小板凝集を惹起する1)他多数。
② 流血中で血栓を安定化する4,5)。
③ 止血への関与は限定的という報告が多い5,21)。
3.血管とリンパ管統合性における役割(出生後)
① 炎症時の血管やリンパ節内高内皮細静脈 (HEV) の integrity 保持(欠損すると炎症部位での毛細血管やリンパ節内HEVからの出血が生じる)8,9)。
② リンパ管・静脈吻合部位での integrity 保持(リンパ管への血液逆流防止)24)
4.免疫での役割(樹状細胞に発現するCLEC-2の役割)
①樹状細胞の CLEC-2 は抗原提示の際に、リンパ管内皮やリンパ節内のポドプラニンと結合することでリンパ管やリンパ節内を移動する10)。
病理学的役割
1.癌
① ポドプラニン発現腫瘍細胞の血行性転移を促進する2,6)。
② ポドプラニン発現腫瘍あるいは発現癌関連線維芽細胞による癌関連血栓症の促進23)。
2.炎症:臓器や炎症惹起物質によって異なるが、炎症促進作用の報告が多い。
① Thromboinflammation促進27,28, 31-33):炎症で血管壁や肝臓マクロファージにPDPNが発現上昇し、血栓形成とそれに続く炎症が促進されるが、脾臓における血栓には関与しない(下大静脈結紮モデル、アセトアミノフェンや四塩化炭素による肝炎モデル、サルモネラ菌感染後肝臓血栓モデルマウスによる検討)。
② 関節炎を促進34): K/BxN マウス血清投与による関節炎モデルマウスによる検討
③ Unsterile inflammation を抑制29,30):LPSや盲腸結紮による腹膜炎モデルマウスによる検討
3.ヘムによる血小板活性化により惹起される病態
① 横紋筋融解症による急性腎不全を促進13)
3)ノック・アウトマウスの表現形
生理的表現型
1.CLEC-2 全身欠損マウスは肺形成不全により出生直後に死亡。巨核球・血小板特異的 CLEC-2 欠損マウス(血小板上に2%程度CLEC-2が残存)は出生し、繁殖も可能5,7,11)。
2.胎生期のリンパ管と血管の分離不全により、血液がリンパ管に流入し、胎仔体表面や成獣腸管・腸間膜を中心に赤い網状影と浮腫が認められる5,7,11)。
3. リンパ節内に出血が認められる8)。
3. tail bleeding モデルマウスで出血傾向の延長なし5,21)。
4. 軽度の血小板減少と軽度の貧血34-36)。
病態モデルにおける表現型
1.尾静脈より注射したポドプラニン発現腫瘍細胞の血行性肺転移が著しく抑制される6,25)。
2.in vivo血栓形成が抑制されるが、出血傾向の有意な増加はない4, 5)。
3.炎症時の毛細血管に出血が認められる9)。
4. 深部静脈血栓症モデルマウスで血栓形成が抑制される27)。(下大静脈結紮モデルで結紮部位の血管壁にポドプラニンが発現する)
5. 炎症に関する表現型
① Thromboinflammationが抑制される: 下大静脈結紮モデルで血栓体積減少27) ,アセトアミノフェンや四塩化炭素による肝炎モデル28,31,32)とサルモネラ菌感染後肝臓血栓モデルマウス33)で血栓形成と臓器障害抑制
② 関節炎が抑制される(K/BxN マウス血清投与による関節炎モデルマウス)34)
③ 炎症増悪:LPSや盲腸結紮による腹膜炎モデルマウスで炎症増悪29,30)
6. 横紋筋融解症による急性腎不全を抑制13)(heme/hemin が CLEC-2 を介して血小板を活性化)
7.CLEC-2 欠損樹状細胞はリンパ管やリンパ節への侵入が阻害され、T細胞の抗原刺激が抑制される10)。
4)病態との関わり
CLEC-2 変異が原因となる疾患は報告されていないが、 Kasabach-Merritt症状を示すカポジ肉腫様血管内皮細胞腫患者では、コラーゲン受容体 Glycoprotein VI とCLEC-2 のコピー数の低下と、それぞれのアゴニストによる血小板活性化が減弱していることが報告された37)。また、ゴーハム病という異常なリンパ管組織により骨溶解が生じる疾患の血小板で、特定のCLEC-2抗体とロドサイチンに反応しない異常なCLEC-2を持つ血小板集団が認められることも報告され38)、病態の進展に一定の役割を持つ可能性もある。
図表
CLEC-2
引用文献
1) Suzuki-Inoue K, Fuller GL, García A, Eble JA, Pöhlmann S, Inoue O, Gartner TK, Hughan SC, Pearce AC, Laing GD, Theakston RD, Schweighoffer E, Zitzmann N, Morita T, Tybulewicz VL, Ozaki Y, Watson SP: A novel Syk-dependent mechanism of platelet activation by the C-type lectin receptor CLEC-2. Blood 107: 542-549, 2006.
2) Suzuki-Inoue K, Kato Y, Inoue O, Kaneko MK, Mishima K, Yatomi Y, Yamazaki Y, Narimatsu H, Ozaki Y: Involvement of the snake toxin receptor CLEC-2, in podoplanin-mediated platelet activation, by cancer cells. J Biol Chem 282: 25993-26001, 2007.
3) Fuller GL, Williams JA, Tomlinson MG, Eble JA, Hanna SL, Pöhlmann S, Suzuki-Inoue K, Ozaki Y, Watson SP, Pearce AC: The C-type lectin receptors CLEC-2 and Dectin-1, but not DC-SIGN, signal via a novel YXXL-dependent signaling cascade. J Biol Chem 282: 12397-12409, 2007.
4) May F, Hagedorn I, Pleines I, Bender M, Vögtle T, Eble J, Elvers M, Nieswandt B: CLEC-2 is an essential platelet-activating receptor in hemostasis and thrombosis. Blood 114: 3464-3472, 2009.
5) Suzuki-Inoue K, Inoue O, Ding G, Nishimura S, Hokamura K, Eto K, Kashiwagi H, Tomiyama Y, Yatomi Y, Umemura K, Shin Y, Hirashima M, Ozaki Y: Essential in vivo roles of the C-type lectin receptor CLEC-2: embryonic/neonatal lethality of CLEC-2-deficient mice by blood/lymphatic misconnections and impaired thrombus formation of CLEC-2-deficient platelets. J Biol Chem 285: 24494-24507, 2010.
6) Kato Y, Kaneko MK, Kunita A, Ito H, Kameyama A, Ogasawara S, Matsuura N, Hasegawa Y, Suzuki-Inoue K, Inoue O, Ozaki Y, Narimatsu H: Molecular analysis of the pathophysiological binding of the platelet aggregation-inducing factor podoplanin to the C-type lectin-like receptor CLEC-2. Cancer Sci 99: 54-61, 2008.
7) Bertozzi CC, Schmaier AA, Mericko P, Hess PR, Zou Z, Chen M, Chen CY, Xu B, Lu MM, Zhou D, Sebzda E, Santore MT, Merianos DJ, Stadtfeld M, Flake AW, Graf T, Skoda R, Maltzman JS, Koretzky GA, Kahn ML: Platelets regulate lymphatic vascular development through CLEC-2-SLP-76 signaling. Blood 116: 661-670, 2010.
8) Herzog BH, Fu J, Wilson SJ, Hess PR, Sen A, McDaniel JM, Pan Y, Sheng M, Yago T, Silasi-Mansat R, McGee S, May F, Nieswandt B, Morris AJ, Lupu F, Coughlin SR, McEver RP, Chen H, Kahn ML, Xia L: Podoplanin maintains high endothelial venule integrity by interacting with platelet CLEC-2. Nature 502: 105-109, 2013.
9) Boulaftali Y, Hess PR, Getz TM, Cholka A, Stolla M, Mackman N, Owens AP, Ware J, Kahn ML, Bergmeier W: Platelet ITAM signaling is critical for vascular integrity in inflammation. J Clin Invest 123: 908-916, 2013.
10) Acton SE, Astarita JL, Malhotra D, Lukacs-Kornek V, Franz B, Hess PR, Jakus Z, Kuligowski M, Fletcher AL, Elpek KG, Bellemare-Pelletier A, Sceats L, Reynoso ED, Gonzalez SF, Graham DB, Chang J, Peters A, Woodruff M, Kim YA, Swat W, Morita T, Kuchroo V, Carroll MC, Kahn ML, Wucherpfennig KW, Turley SJ: Podoplanin-rich stromal networks induce dendritic cell motility via activation of the C-type lectin receptor CLEC-2. Immunity 37: 276-289, 2012.
11) Osada M, Inoue O, Ding G, Shirai T, Ichise H, Hirayama K, Takano K, Yatomi Y, Hirashima M, Fujii H, Suzuki-Inoue K, Ozaki Y: Platelet activation receptor CLEC-2 regulates blood/lymphatic vessel separation by inhibiting proliferation, migration, and tube formation of lymphatic endothelial cells. J Biol Chem 287: 22241-22252, 2012.
12) Inoue O, Hokamura K, Shirai T, et al. Vascular Smooth Muscle Cells Stimulate Platelets and Facilitate Thrombus Formation through Platelet CLEC-2: Implications in Atherothrombosis. PLoS One. 2015;10(9):e0139357.
13) Oishi S, Tsukiji N, Otake S, et al. Heme activates platelets and exacerbates rhabdomyolysis-induced acute kidney injury via CLEC-2 and GPVI/FcRγ. Blood Adv. 2021;5(7):2017-2026.
14) Bourne JH, Colicchia M, Di Y, et al. Heme induces human and mouse platelet activation through C-type-lectin-like receptor-2. Haematologica. 2021;106(2):626-629.
15) Manne BK, Getz TM, Hughes CE, et al. Fucoidan is a novel platelet agonist for the C-type lectin-like receptor 2 (CLEC-2). J Biol Chem. 2013;288(11):7717-7726.
16) Alshehri OM, Montague S, Watson S, et al. Activation of glycoprotein VI (GPVI) and C-type lectin-like receptor-2 (CLEC-2) underlies platelet activation by diesel exhaust particles and other charged/hydrophobic ligands. Biochem J. 2015;468(3):459-473.
17) Yokomori R, Shirai T, Tsukiji N, et al. C-type lectin-like receptor-2 (CLEC-2) is a key regulator of kappa-carrageenan-induced tail thrombosis model in mice. Platelets. 2023;34(1):2281941.
18) Chang YW, Hsieh PW, Chang YT, et al. Identification of a novel platelet antagonist that binds to CLEC-2 and suppresses podoplanin-induced platelet aggregation and cancer metastasis. Oncotarget. 2015;6(40):42733-42748.
19) Tsukiji N, Osada M, Sasaki T, et al. Cobalt hematoporphyrin inhibits CLEC-2-podoplanin interaction, tumor metastasis, and arterial/venous thrombosis in mice. Blood Adv. 2018;2(17):2214-2225.
20) Watanabe N, Shinozaki Y, Ogiwara S, et al. Diphenyl-tetrazol-propanamide Derivatives Act as Dual-Specific Antagonists of Platelet CLEC-2 and Glycoprotein VI. Thromb Haemost. 2024;124(3):203-222.
21) Haji S, Ito T, Guenther C, et al. Human Dectin-1 is O-glycosylated and serves as a ligand for C-type lectin receptor CLEC-2. Elife. 2022;11.
22) Hughes CE, Pollitt AY, Mori J, et al. CLEC-2 activates Syk through dimerization. Blood. 2010;115(14):2947-2955.
23) Shirai T, Tsukiji N, Sasaki T, et al. Cancer-associated fibroblasts promote venous thrombosis through podoplanin/CLEC-2 interaction in podoplanin-negative lung cancer mouse model. J Thromb Haemost. 2023;21(11):3153-3165.
24) Hess PR, Rawnsley DR, Jakus Z, et al. Platelets mediate lymphovenous hemostasis to maintain blood-lymphatic separation throughout life. J Clin Invest. 2014;124(1):273-284.
25) Shirai T, Inoue O, Tamura S, et al. C-type lectin-like receptor 2 promotes hematogenous tumor metastasis and prothrombotic state in tumor-bearing mice. J Thromb Haemost. 2017;15(3):513-525.
26) Tsukiji N, Inoue O, Morimoto M, et al. Platelets play an essential role in murine lung development through Clec-2/podoplanin interaction. Blood. 2018;132(11):1167-1179.
27) Payne H, Ponomaryov T, Watson SP, Brill A. Mice with a deficiency in CLEC-2 are protected against deep vein thrombosis. Blood. 2017;129(14):2013-2020.
28) Chauhan A, Sheriff L, Hussain MT, et al. The platelet receptor CLEC-2 blocks neutrophil mediated hepatic recovery in acetaminophen induced acute liver failure. Nat Commun. 2020;11(1):1939.
29) Rayes J, Lax S, Wichaiyo S, et al. The podoplanin-CLEC-2 axis inhibits inflammation in sepsis. Nat Commun. 2017;8(1):2239.
30) Bourne JH, Beristain-Covarrubias N, Zuidscherwoude M, et al. CLEC-2 Prevents Accumulation and Retention of Inflammatory Macrophages During Murine Peritonitis. Front Immunol. 2021;12:693974.
31) Xie Z, Jiang J, Yang F, et al. The C3/C3aR pathway exacerbates acetaminophen-induced mouse liver injury via upregulating podoplanin on the macrophage. Faseb j. 2025;39(1):e70272.
32) Perez-Toledo M, Beristain-Covarrubias N, Pillaye J, et al. Discrete and conserved inflammatory signatures drive thrombosis in different organs after Salmonella infection. Nat Commun. 2025;16(1):2356.
33) Hitchcock JR, Cook CN, Bobat S, et al. Inflammation drives thrombosis after Salmonella infection via CLEC-2 on platelets. J Clin Invest. 2015;125(12):4429-4446.
34) Nakamura-Ishizu A, Takubo K, Kobayashi H, Suzuki-Inoue K, Suda T. CLEC-2 in megakaryocytes is critical for maintenance of hematopoietic stem cells in the bone marrow. J Exp Med. 2015;212(12):2133-2146.
35) Tamura S, Suzuki-Inoue K, Tsukiji N, et al. Podoplanin-positive periarteriolar stromal cells promote megakaryocyte growth and proplatelet formation in mice by CLEC-2. Blood. 2016;127(13):1701-1710.
36) Otake S, Sasaki T, Shirai T, et al. CLEC-2 stimulates IGF-1 secretion from podoplanin-positive stromal cells and positively regulates erythropoiesis in mice. J Thromb Haemost. 2021;19(6):1572-1584.
37) Martyanov AA, Tesakov IP, Khachatryan LA, et al. Platelet functional abnormalities in pediatric patients with kaposiform hemangioendothelioma/Kasabach-Merritt phenomenon. Blood Adv. 2023;7(17):4936-4949.
38) Oishi S, Tsukiji N, Segawa T, Takano K, Hasuda N, Suzuki-Inoue K. Abnormalities in C-type lectin-like receptor 2 in a patient with Gorham-Stout disease: the first case report. Res Pract Thromb Haemost. 2024;8(1):102273.
39) Kazama F, Nakamura J, Osada M, et al. Measurement of soluble C-type lectin-like receptor 2 in human plasma. Platelets. 2015;26(8):711-719.
40) Inoue O, Osada M, Nakamura J, et al. Soluble CLEC-2 is generated independently of ADAM10 and is increased in plasma in acute coronary syndrome: comparison with soluble GPVI. Int J Hematol. 2019;110(3):285-294.
41) Kawamura M, Ueda M, Matsushita S, et al. Development of an automated chemiluminescence enzyme immunoassay for the measurement of soluble C-type lectin-like receptor 2 (sCLEC-2) and molecular forms of sCLEC-2 measured in patient plasma. Platelets. 2024;35(1):2420949.
42) Uchiyama S, Suzuki-Inoue K, Wada H, et al. Soluble C-type lectin-like receptor 2 in stroke (CLECSTRO) study: protocol of a multicentre, prospective cohort of a novel platelet activation marker in acute ischaemic stroke and transient ischaemic attack. BMJ Open. 2023;13(9):e073708.
参考文献
1) Suzuki-Inoue K, Shirai T, Tsukiji N. Platelet CLEC-2. In: Gresele P, López JA, Angiolillo DJ, P C, eds. Platelet Physiology Volume 1. Vol. 1. New York: Springer Nature; 2025:247-262.
2) Tsukiji N, Suzuki-Inoue K. Impact of Hemostasis on the Lymphatic System in Development and Disease. Arterioscler Thromb Vasc Biol. 2023;43(10):1747-1754.
3) 井上克枝, 築地長治, 白井俊光, 佐々木知幸. 特集:血小板の基礎から臨床応用 血小板活性化受容体CLEC-2の基礎研究から臨床応用に向けた取り組み. 日本血栓止血学会誌. 2023;34(4):414-421.
4) 井上克枝. 新たな生体内血小板活性化マーカーsoluble CLEC-2. 臨床血液. 2024 65(9):1106-1115.
