- 大分類
-
- 血管
- 小分類
-
- 分子
アンジオスタチン angiostatin
解説
1.アンジオスタチン発見の経緯
マウスに皮下移植したルイス肺癌細胞の肺への転移を観察した際、皮下に腫瘍が存在すれば肺転移巣は微小の状態に留まるが、皮下の腫瘍を除去すると肺転移巣が急速に増大したことから、皮下腫瘍から放出される因子が、肺転移巣を微小の状態に維持したとの考えから、担癌動物の血中から血管新生抑制活性のあるタンパクとして発見されたものであり、その実体はプラスミノゲンの分解産物である(1)。
2.アンジオスタチンの由来
プラスミノゲンは、広く生体内に分布し、プラスミノゲンアクチベーター(PA)によってプラスミンに変換されてフィブリンなどを分解する。プラスミノゲンの分子内には“クリングル”ドメインを5つ連結しており、オリジナルのアンジオスタチンは、このプラスミノゲンの5つのクリングル構造のうちK1からK4までの38kDaのタンパクである(1)。なお、個々のクリングルのうちでは、K4には血管新生抑制活性はない。K4のないK1からK3までの断片は、オリジナルのアンジオスタチン(K1からK4まで)より血管新生抑制活性が強く、K1からK3までの断片を含めてアンジオスタチンと呼ばれる(図)(2)。
アンジオスタチンは、PAによってプラスミノゲンから変換されたプラスミンが、PGK (phosphoglycerate kinase)によって還元されたのち、プラスミンを含むセリンプロテアーゼ群とMMP(matrix metalloproteinase)群とによって分解されることにより生成される(3)。
3.アンジオスタチンの作用発現
アンジオスタチンが血管新生抑制作用を発揮する機序との関連で、これまでにアンジオスタチンと結合するタンパクが複数同定されている(4)。最初に同定されたのがATP合成酵素である。ATP合成酵素は本来ミトコンドリアの膜に局在するタンパクであるが、ミトコンドリアの膜タンパクが細胞膜にも存在することが示されており、実際アンジオスタチンが細胞膜のATP合成酵素に結合することは複数のグループによっても確認されている。次に、アンジオスタチン結合タンパクとして同定されたのがアンジオモーチン(angiomotin)である。アンジオモーチンは675個のアミノ酸で構成される分子量72kDaのタンパクであり、血管内皮細胞に比較的選択的に発現し、focal adhesion kinase(FAK)活性を増強することで内皮細胞の遊走能を促進的に調節する分子であり、アンジオスタチンはこのアンジオモーチンの機能を阻害することが示されている。これら以外にもアンジオスタチンは、インテグリンαvβ3、アネキシンA2、HGF受容体であるc-met、コンドロイチン硫酸プロテオグリカンのNG2(new glue 2)や、さらには1998個のアミノ酸からなるABSP(angiostatin binding sequence protein)と結合することが報告されている(4)。
図表
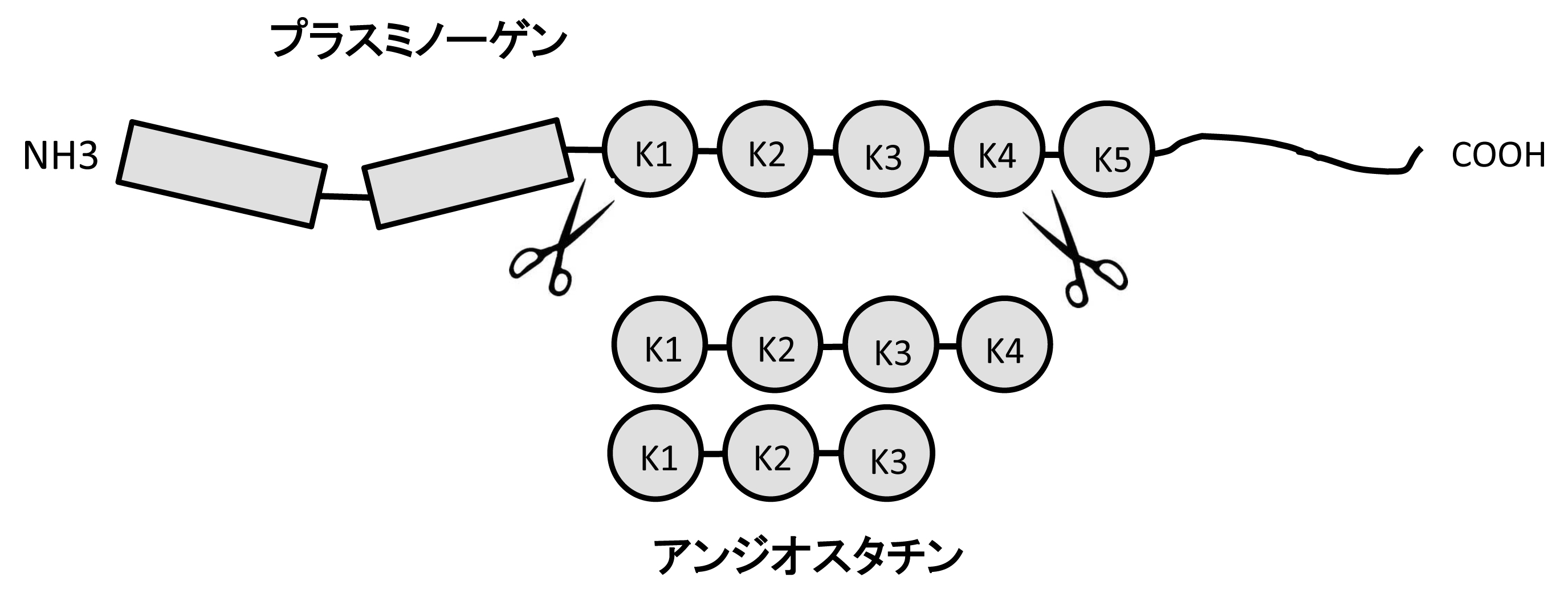
図 プラスミノゲンとアンジオスタチン:アンジオスタチンは、プラスミノゲンにコードされている5つのクリングル構造のうち1から4、または1から3まで断片である。(血管生物医学辞典,朝倉書店,2011より引用)
参考文献
1) O’Reilly MS, Holmgren L, Shing Y, Chen C, Rosenthal RA, Moses M, Lane WS, Cao Y, Sage EH, Folkman J: Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma. Cell 79: 315
2) Cao Y, Ji RW, Davidson D, Schaller J, Marti D, Söhndel S, McCance SG, O’Reilly MS, Llinás M, Folkman J: Kringle domains of human angiostatin. Characterization of the anti-proliferative activity on endothelial cells. J Biol Chem 271: 29461
3) Lay AJ, Jiang XM, Daly E, Sun L, Hogg PJ: Plasmin reduction by phosphoglycerate kinase is a thiol-independent process. J Biol Chem 277: 9062
4) Wahl ML, Kenan DJ, Gonzalez-Gronow M, Pizzo SV: Angiostatin’s molecular mechanism: aspects of specificity and regulation elucidated. J Cell Biochem 96: 242
