- 大分類
-
- 血小板
- 小分類
-
- 分子
ラミニン Laminin
解説
解説
【概要】
基底膜の主要な構成分子である糖タンパク質。血管内皮基底膜にも豊富に存在する。インテグリンの接着部位を持ち、細胞接着の足場となる。血管壁のラミニンは血小板活性化能も有する。
【分子量】
約850kDa(α, β, γサブユニット鎖からなる3量体)
【構造と機能】
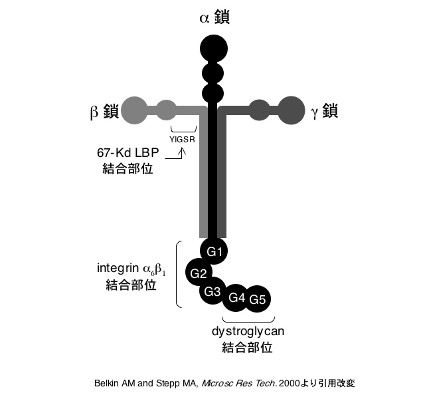
血小板にも発現するインテグリン α6β1 (α6β1)との結合部位を有する440 kDaのα鎖、220 kDaのβ鎖、205 kDaのγ鎖が十字架状に会合した特徴的な形状をしている(図1)。α鎖は5種類 、β鎖は 3種類、γ鎖は 3種類存在し、組み合わせにより16種類以上のラミニンが存在する。発見順にラミニン-1やラミニン-2等と命名されていたが、現在はラミニンαβγ各サブユニットの番号をラミニンの後に記載し、ラミニン-○△□という形で表記されている。血管壁には主にα4およびα5を持つラミニン「ラミニン-411、ラミニン-421、ラミニン-511、ラミニン-521」が発現しており(1)、それぞれ以前のラミニン-8、ラミニン-9、ラミニン-10、ラミニン-11に相当する。血管壁由来ラミニンは血小板接着能と活性化能を有する(2)。血管壁由来ラミニンへの血小板接着は血小板膜上のα6β1を介する。活性化はglycoprotein VI (GPVI)に依存している(2)。血管壁傷害部位に生ずる高ずり応力下でもラミニンへの血小板接着と血栓形成が認められる。このような状況下では、まずラミニンへフォン・ヴィレブランド因子(VWF)が結合し、血小板がGPIb/IX/Vを介して粘着することでラミニンとα6β1、GPVIの結合が可能となる。このメカニズムは、血管壁を構成する細胞外物質であるコラーゲンへの血小板接着メカニズムと相同である(3)。このような基質と受容体のリダンダンシー(冗長性)は、病的状況下における血栓形成に重要であり近年他の研究グループによっても確認された(4)。
【病態との関わり】
ラミニンα5鎖欠損マウスは胎生致死(5)。インテグリンα6β1欠損マウスは出血傾向を認めないが血管傷害モデルで血栓形成が抑制されるため、ラミニン-α6β1は抗血栓薬の標的として有望である可能性が示唆されている(4)。
【その他】
ラミニン固相化ビーズを用いたアフィニティークロマトグラフィーで抽出される血小板膜タンパク67-Kd ラミニン結合タンパク(67-Kd LBP)も血小板のラミニン受容体として報告されている(6)。67-Kd LBPは酵素活性を持たない変異型βガラクトシダーゼで(7)、ラミニンβ鎖のYIGSR配列(アミノ酸一文字表記)を認識するが(6)、血小板機能への影響は不明である。
ラミニンと細胞骨格を繋ぐ機械受容体として知られるディストロフィン結合タンパクであるディストログリカンは血小板にも発現しているが(8)、その生理的役割は解明されていない。
図表
引用文献
1) Hallmann R, Horn N, Selg M, Wendler O, Pausch F, Sorokin LM: Expression and function of laminins in the embryonic and mature vasculature. Physiol Rev 85: 979–1000, 2005.
2) Inoue O, Suzuki-Inoue K, McCarty OJ, Moroi M, Ruggeri ZM, Kunicki TJ, Ozaki Y, Watson SP: Laminin stimulates spreading of platelets through integrin alpha6beta1-dependent activation of GPVI. Blood 107: 1405–1412, 2006.
3) Inoue O, Suzuki-Inoue K, Ozaki Y: Redundant mechanism of platelet adhesion to laminin and collagen under flow: involvement of von Willebrand factor and glycoprotein Ib-IX-V. J Biol Chem 283: 16279–16282, 2008.
4) Schaff M et al: Circulation. 30: 128: 541-552, 2013.
5) Miner JH, Cunningham J, Sanes JR: Roles for laminin in embryogenesis: exencephaly, syndactyly, and placentopathy in mice lacking the laminin alpha5 chain. J Cell Biol 143: 1713–1723, 1998.
6) Tandon NN et al: Biochem J. 274(Pt 2): 535-542, 1991.
7) Hinek A, Rabinovitch M, Keeley F, Okamura-Oho Y, Callahan J: The 67-kD elastin/laminin-binding protein is related to an enzymatically inactive, alternatively spliced form of beta-galactosidase. J Clin Invest 91: 1198–1205, 1993.
8) Austin RC, Fox JE, Werstuck GH, Stafford AR, Bulman DE, Dally GY, Ackerley CA, Weitz JI, Ray PN: Identification of Dp71 isoforms in the platelet membrane cytoskeleton. Potential role in thrombin-mediated platelet adhesion. J Biol Chem 277: 47106–47113, 2002.