- 大分類
-
- 凝固
- 小分類
-
- 疾患
第XIII因子欠乏症・異常症 factor XIII deficiency / abnormality
解説
凝固第XIII因子(FXIII)欠乏症は、先天的もしくは後天的要因により血液中のFXIII因子が欠乏した結果引き起こる出血性疾患である。
[先天性FXIII欠乏症]
分類・疫学
触媒サブユニットであるAサブユニット(FXIII-A)をコードするF13A、もしくはFXIII-Aの保護・補助に働くBサブユニット(FXIII-B)をコードするF13Bいずれかの遺伝子の異常が原因である、常染色体潜性遺伝形式の疾患である1)。起因となる遺伝子により、FXIII-A欠乏症とFXIII-B欠乏症に分類される。FXIII-A欠乏症は100 ~ 400万人に一人とされ、世界中のあらゆる人種・地域に広く分布している。一方、FXIII-B欠乏症は数十例が報告されているのみである2,3)。
病態
生涯にわたる出血傾向と創傷治癒異常、女性患者の反復性流産を主症状とする。
出血の初発症状として出生後の臍出血が典型的であり、そののち関節や筋肉内での頻回な出血を認める。頭蓋内出血・腹腔内出血による死亡例も報告されている。FXIII欠乏症では出血の際フィブリン多量体が形成されるので一時的に止血するが、血栓が不安定で早期に融解されるために24~36時間後に再び出血する「後出血(delayed bleeding)」を特徴とする。
病因
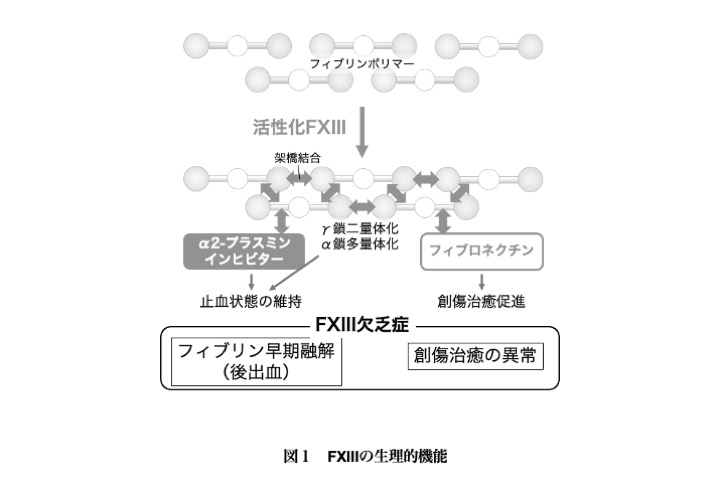
血中FXIII(-A)の欠乏によって、フィブリン分子間の架橋結合が形成されないとともに、抗線溶因子であるα2-プラスミンインヒビターがフィブリンに取り込まれなくなるため、早期に血栓が溶解されて再出血に至る(図1)。また、フィブロネクチンのフィブリンへの取り込みを欠くために、線維芽細胞の増殖および細胞外マトリックス産生が低下して、創傷治癒の遅延がもたらされると考えられている。
FXIII-A欠乏症では、F13A遺伝子変異がmRNA産生・安定性の低下や翻訳産物の細胞内外での安定性低下をもたらし、その結果FXIII-Aが欠乏する。F13Aには、エクソン内外の1〜数塩基の欠失・挿入、ミスセンス変異、ナンセンス変異や複数エクソンにまたがる領域の欠失など、遺伝子全体にわたって多数の変異が同定されている3)。FXIII-Aタンパク質自体は存在するがその機能のみを低下させる、いわゆる分子異常型の変異は、これまでのところ2例だけが報告されている。
FXIII-B欠乏症では、F13B遺伝子変異に起因したFXIII-Bの欠損により、二次的に血漿中のFXIII-Aが著しく減少する。F13Bで報告されているのは、8つのミスセンス変異、3つのスプライス部位変異、3つの挿入変異、2つの欠失変異であり3-7)、これらのうちいくつかはFXIII-Bの産生もしくは分泌不全を引き起こすことが確認されている6,8)。
診断
古くから、試験管内で作成した血栓の尿素(5 M)などに対する易溶解性を調べる血栓溶解試験が用いられてきたが、FXIII活性が1%以上の欠損症例を見逃す可能性が高いので現在では推奨されていない。より直接、血漿中のFXIIIの酵素(トランスグルタミナーゼ)活性を測定する方法として、カゼインなどのタンパク質基質に、酵素反応の結果一定時間に取込まれる低分子アミン基質量を測定するアミン取込み法、あるいは、基質消費時に放出されるアンモニア量を測定するアンモニア放出法があり、いずれの方法においても、正常の70%未満であればFXIII欠損症が疑われる。血漿中のFXIII-AとFXIII-B抗原量をELISA法、Laurell法、もしくはWestern blot法により測定し、(1) FXIII-Aが基準範囲以下、FXIII-Bが基準範囲あるいはやや低下していればFXIII-A欠損症、(2) FXIII-Aが基準範囲から10%以下、FXIII-Bが基準範囲以下であればFXIII-B欠損症の可能性が極めて高い。患者が若齢であり、出生時から続く出血傾向、家系内での出血症例の存在、および家系内のメンバーにFXIIIの低下がみとめられる場合、先天性欠損症と考えてよい。後述する後天性FXIII欠乏症を除外する必要があることは言うまでもない。
家系内の症例の遺伝子異常が判明している場合や創始者効果が原因である場合は、遺伝子診断が有用である。
治療と予後
出血時、手術の前後に、新鮮血漿、ヒト血液由来のFXIII濃縮製剤、あるいは組換えFXIII-A製剤を用いて補充療法を行なう。出血の部位、重症度に応じて、血漿FXIIIレベルを正常の20~100%まで上げる。組換え製剤中のFXIII-AはFXIII-A欠損症患者血中のFXIII-Bと結合して安定化されるので、その半減期は7~10日間と長いが、大量出血が持続している場合は活性化と失血によってFXIII-Aの半減期が短縮するので、より頻回の補充が必要である。FXIII-B欠損症患者では血中にFXIII-Bが存在しないことから、両サブユニットの複合体を含んだ血液由来のFXIII製剤の補充が適している。
[後天性FXIII欠乏症]
出血傾向の家族歴、既往歴がなく、高齢になってFXIIIが減少して突然出血症状を呈する症例も少なくない。後天的にFXIIIが減少する原因として、けがや手術に伴う出血、あるいはDIC等による消費の亢進、炎症反応や抗ガン治療(抗ガン剤、放射線照射)に伴う産生低下、FXIIIに対する自己抗体(インヒビター)の産生などが考えられる。このうち、自己抗体による後天的なFXIII欠乏症(自己免疫性第XIII因子欠乏症 autoimmune factor XIII deficiency, AiF13D)について、2009年より我が国での全国規模での実態調査を行なっており9)、2025年4月までに日本人のみで80症例を確認している。
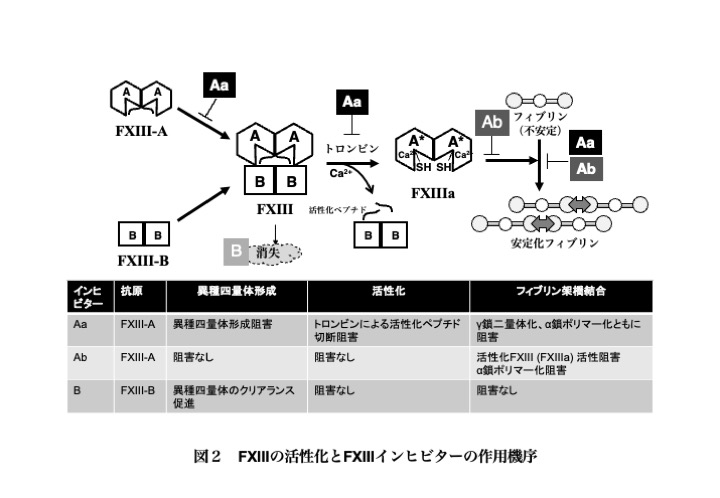
抗FXIII自己抗体には、①抗FXIII-A IgGで、トロンビンによる活性化およびFXIII-Bとの異種四量体形成を阻害するタイプ(Aa型)、②抗FXIII-A IgGで、活性化したFXIII-Aの触媒活性を阻害するタイプ(Ab型)、③抗FXIII-B IgGで、血中のFXIII抗原を著しく低下させるタイプ(B型)の3種に分類されている(図2)10)。いずれも最終的にはフィブリンおよびα2-PIの架橋結合を著しく遅延して、止血困難に至る。
AiF13Dは、既往歴、家族歴がなく比較的高齢(平均66歳)で発症し、プロトロンビン時間、活性化部分トロンボプラスチン時間の異常を示さず多くの場合血小板の数と機能も正常である。広範かつ多発性の皮下あるいは筋肉内出血が主症状であり、腹腔内、脳内出血も数例確認されている。およそ2割の症例が死亡しているが、何れも検査、診断、治療の遅れなどが関連しており、原因不明の出血症例に遭遇した場合は、必ず FXIII「活性」を測定することを強く推奨する。また、基本的にはFXIII活性の1:1交叉混合試験(症例と健常対照の血漿検体を使用)が診断に有用であり、アンモニア放出法による測定ではAa型は混合試験により著しい阻害を示す。一方、B型ではFXIII活性のみを指標にした診断は困難である。いずれのタイプも組換体FXIII-A, FXIII-Bを抗原としたドットブロット解析やELISAにより確定診断されるが、受注してくれる検査センターが存在しないことが問題である。
AiF13Dは抗FXIII自己抗体が原因であるため、FXIII製剤を投与しても阻害もしくは迅速に除去(クリアランス)されて効果が弱いだけでなく、場合によっては抗体価を高めて悪化させる危険性もある。従って、免疫抑制剤の併用が必須である。
図表
引用文献
1. Ichinose A: Physiology and regulation of factor XIII. Thromb Haemost 86: 57-65, 2001.
2. Ichinose A: Factor XIII is a key molecule at the interaction of coagulation and fibrinolysis as well as inflammation and infection control. Int J Hematol 95: 362-370, 2012.
3. Javed H et al: Genetic landscape in coagulation factor XIII associated defects – advances in coagulation and beyond. Blood Rev 59: 1-28, 2023.
4. Hashiguchi T, et al: Two genetic defects in a patient with complete deficiency of the b-subunit for coagulation factor XIII. Blood 82: 145-150, 1993.
5. Izumi T, et al: Type I factor XIII deficiency is caused by a genetic defect of its b subunit: insertion of triplet AAC in exon III leads to premature termination in the second Sushi domain. Blood 87: 2769-2774, 1996.
6. Koseki S, et al: Truncated mutant B subunit for factor XIII causes its deficiency due to impaired intracellular transportation. Blood 97: 2667-2672, 2001.
7. Ivaskevicius V, et al: Mutations affecting disulfide bonds contribute to a fairly common prevalence of F13B gene defects: results of a genetic study in 14 families with factor XIII B deficiency. Haemophilia 16: 675-682, 2010.
8. Hashiguchi T, Ichinose A: Molecular and cellular basis of deficiency of the b subunit for factor XIII secondary to a Cys430-Phe mutation in the seventh Sushi domain. J Clin Invest 95: 1002-1008, 1995.
9. Ichinose A, Osaki T, Souri M: Autoimmune acquired factor XIII deficiency in Japan update: focused on annual incidence and clinical features. Haemophilia 28: e121-124, 2022.
10. Souri M, Osaki T, Ichinose A: Anti-factor XIII A subunit (FXIII-A) autoantibodies block FXIII-A2B2 assembly and steal FXIII-A from native FXIII-A2B2. J Thromb Haemost 13: 802-814, 2015